Overbehandles kreftpasienter?

Gentester har gjort at aggressiv kreftbehandling kan minimeres. Men kreftforsker Hege Russnes mener Norge bruker for lang tid på å ta diagnostikken i bruk i en mer persontilpasset behandling.
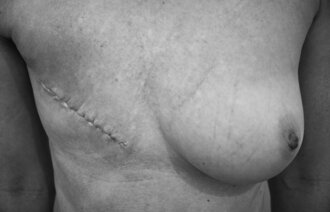
– På 90-tallet skjøt vi en del spurv med kanoner i kreftbehandlingen, med det resultatet at pasienten fikk store seneffekter. I noen tilfeller førte det til sekundærkreft, sier Else Støring.
Hun jobbet som kreftsykepleier fra 80-tallet til 2005. Siden da har hun vært spesialrådgiver i Kreftforeningen. Kreftsykepleier var hun ved både St. Olavs hospital og Radiumhospitalet.
– Jeg har ikke opplevd, og opplever heller ikke i dag, at noen bevisst driver overbehandling av kreftpasienter. Men på 90-tallet visste vi ikke bedre. Det ga gode resultater på overlevelse, men vi var ikke klar over alle seneffektene, sier hun.

– Skyldes ikke overbehandling
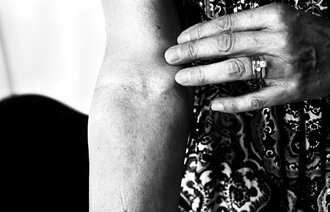
På Røros tilbyr LHL-klinikkene rehabilitering blant annet av kreftpasienter. Frode Skanke, som er avdelingsoverlege der, har merket at stadig flere sliter med senskader av kreftbehandling, men han tror ikke at det skyldes overbehandling.
– Det har blitt mer oppmerksomhet om dette. Historiene begynner å bli fortalt. Kanskje var det slik før at hvis du var vellykket behandlet for kreft, skulle du stilltiende akseptere konsekvensene av behandling og være glad og fornøyd. Slik er det ikke lenger.
Skanke har ikke møtt pasienter med seneffekter hvor man definitivt kan si at de har vært overbehandlet.
– Nasjonale handlingsprogrammer har heldigvis regulert det slik at behandling skal være standardisert og basert på protokoller og forskning. Så vil ny forskning selvsagt igjen endre ting, slik at man retrospektivt kan si at noen var overbehandlet. På den annen side: Hvem tør å ta sjansen på å underbehandle?

Multigentester kun for studier
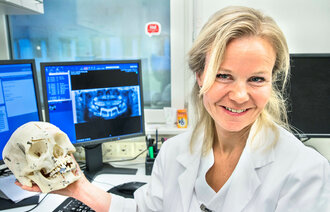
– Over de siste tiårene har brystkreftpasienter i økende grad fått behandling med cellegift, sier Hege Russnes, forsker og patolog ved Oslo universitetssykehus, Ullevål.
Og akkurat det er et paradoks, fordi det er også nå verden har teknologien som, på et tidlig stadium, kan hjelpe til å finne de pasientene som mest sannsynlig ikke trenger aggressiv kreftbehandling. For brystkreftpasienter vil det si cellegift og eventuelt hormonterapi etter kirurgi.
Molekylære tester, hvor man undersøker endringer i svært mange gener i svulstvevet (gentesting), muliggjør en mer persontilpasset behandling og kan bidra til å unngå overbehandling. Men ifølge Russnes blir teknologien først og fremst brukt i kliniske studier.
– Labstrukturen, infrastrukturen og finansieringen i Norge er ikke lagt opp til å bruke slike avanserte molekylære tester. Dermed blir det opp til lokale ildsjeler om man får til studier, og om pasientene får mulighet til å bli med og få nyttiggjort seg av de endrede behandlingsmulighetene moderne tester tilbyr, sier hun.
Tidkrevende morfologiske undersøkelser
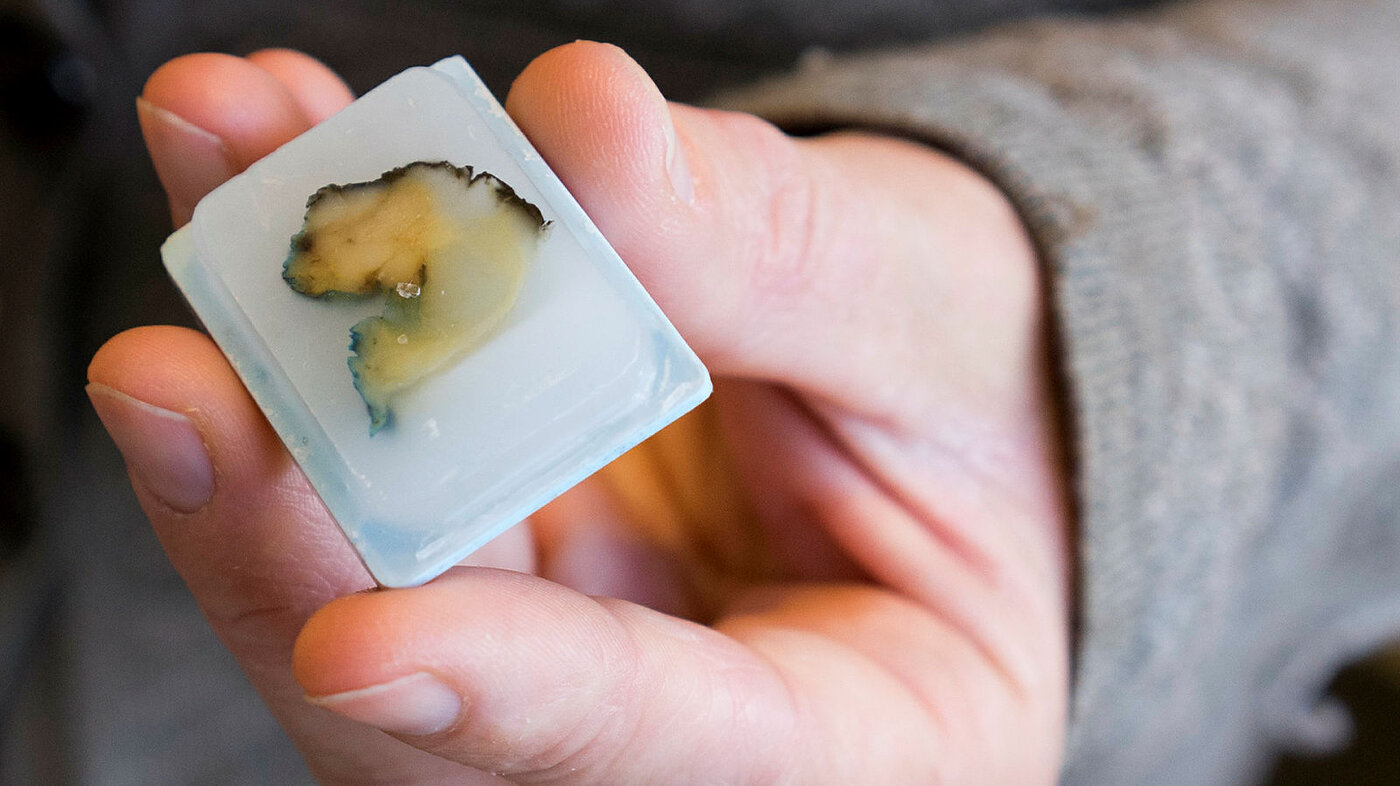
Russnes viser vei gjennom korridorene på patologisk avdeling i andre etasje i laboratoriebygget på Ullevål. Veggene er dekket av hvite skuffeseksjoner. De inneholder de fysiske vevsprøvene fra tusenvis av pasienter fra de siste årene. Flesteparten av prøvene er tatt for å bekrefte eller avkrefte mistanke om kreft.
Inne på kontoret står mikroskopet ved siden av pc-en. Russnes drar frem en rosa vevsprøve som er klemt mellom to glasskiver. Under mikroskopet finner hun rikelig med celler i svulstvevet som er farget brune. Det tyder på at eieren av vevsprøven har en svulst som uttrykker proteinet Ki-67. Ifølge handlingsprogrammet for brystkreft har vedkommende da økt risiko for tilbakefall av sykdommen og bør få cellegift etter kirurgi.
Slike morfologiske undersøkelser av celler, i tillegg til vurdering av svulstvevets arkitektur og sammensetning, tar tid og krever lang erfaring. Dessuten har resultatet en viss usikkerhet heftet ved seg for noen pasienter.
– For noen undergrupper av pasienter klarer vi ikke å reprodusere hverandres funn optimalt ved denne metoden, sier Russnes.
50 gener i stedet for ett protein
Men i de senere årene har det skjedd en stille teknologisk revolusjon. Molekylærbiologi kombinert med bioinformatikk har gitt behandlerne nye diagnostiske verktøy. Et slikt verktøy er for eksempel gentester, der laboratorieanalyser kan oppdage endringer i kreftcellene som ikke er synlige i mikroskopet (for eksempel genforandringer). Ved avansert databehandling kan man få ut et tall som ofte betegnes som en score.
For brystkreftpasienter vil en analyse av 50 gener kunne gi informasjon om hvilken svulsttype pasienten har, og hvor «aktivt» cellene deler seg.
– Dermed har vi plutselig 50 gener å forholde oss til, i stedet for bare ett protein. Tallet sier noe om hvor stor risiko vedkommende har for å få tilbakefall av brystkreften, og vil være et nytt verktøy når legen og pasienten sammen skal bestemme videre behandling, sier Russnes.
– Så testen vil ikke si klart enten ja eller nei til cellegift etter kirurgi?
– Nei, det blir viktig å ta med helhetsbildet rundt pasientens liv og sykdom før man bestemmer seg. Men testen vil gi en bedre pekepinn på om det kan ha stor eller liten betydning for pasienten å utsette seg for seks måneders cellegift eller ikke.
Halvparten kan unngå cellegift etter kirurgi
I 2016 fikk 3371 kvinner og 31 menn brystkreft. Nesten 70 prosent av dem har en undergruppe av brystkreft som er såkalt hormonreseptorpositiv.
I sommer kom en amerikansk studie som viste at bruk av gentest kan gjøre at rundt sju av ti kvinner med slik hormonfølsom brystkreft uten spredning kan unngå cellegift etter kirurgi.
Overlege Hans Erik Eikesdal ved kreftavdelingen på Haukeland universitetssykehus uttalte til VG at «det er for mange pasienter i Norge som overbehandles, med alle de bivirkningene det fører med seg. Resultatene fra denne studien må vi ta med oss hjem. Den vil kanskje føre til endret praksis».
– De behandler kreft mer aggressivt i USA enn i Norge, sannsynligvis på grunn av frykten for søksmål. Vi regner derfor ikke med like stor effekt i Norge. I en forstudie vi har utført med en gentest, ser vi at rundt 30–50 prosent av dem som med dagens retningslinjer ville fått cellegift, sannsynligvis kan unngå det hvis vi innfører metoden, sier Russnes.
En dansk studie fra i fjor har også vist noe av det samme, og testen er nå innført i Danmark som del av rutinediagnostikk for en undergruppe av brystkreftpasientene.

– Norge ligger etter
Hege Russnes mener Norge ligger mange år etter våre naboland med å persontilpasse kreftbehandlingen.
– Hva er det for eksempel Sverige gjør annerledes?
– De er kommet lenger med finansieringen og har øremerket satsing på infrastruktur for molekylære analyser. Hensikten er nok å implementere persontilpasset medisin på nasjonalt nivå. De har også store private stiftelser som bidrar med betydelig finansiering.
– Apropos finansiering: Hvor mye dyrere blir det med denne gentesten?
– En test koster i underkant av 20 000 kroner. Med arbeidskraften som trengs for å gjøre analysene, blir summen cirka 24 000 kroner for en test. Men så kan man trekke fra for det man sparer på samfunnsmessige omkostninger som mindre sykmeldinger og uføretrygd.































0 Kommentarer