Kjennetegn ved sykehjemsbeboere med langtkommen demens og smerter
Sammendrag
Bakgrunn: Det antas at smerte rammer over halvparten av sykehjemsbeboere med langtkommen demens, men det er lite forskning på hva som kjennetegner disse beboerne med smerte. Tidligere forskning på kliniske og demografiske kjennetegn hos personer med smerte er oftest basert på kognitivt friske voksne. Det er derfor nødvendig med kunnskap om hva som kjennetegner eldre sykehjemsbeboere som lever med langtkommen demens og smerter, da det kan belyse det sammensatte sykdomsbildet og behovene til disse personene. Denne kunnskapen kan bidra til at helsepersonell utvikler ferdigheter i observasjoner og vurderinger for å identifisere behov for tiltak.
Hensikt: Å kartlegge forekomsten av smerte blant sykehjemsbeboere med langtkommen demens. Vi ønsket også å undersøke hva som kjennetegner sykehjemsbeboere med langtkommen demens og smerte ved å sammenlikne kliniske og demografiske kjennetegn mellom en gruppe beboere med smerter og en gruppe beboere uten smerter.
Metode: Studien er en kvantitativ beskrivende studie med et tverrsnittsdesign. Totalt deltok 112 sykehjemsbeboere fra 16 sykehjem. Sykepleiere ved de enkelte sykehjemmene brukte et standardisert skjema for å samle inn demografiske data. De benyttet også validerte kartleggingsverktøy for å samle inn kliniske data om smerte, nevropsykiatriske og depressive symptomer, agitasjon, personnære aktiviteter i dagliglivet, somatisk helse og livskvalitet. Data om bruk av smertestillende legemidler og psykoleptika hentet vi fra beboernes medisinlister.
Resultat: Kartleggingen tilsa at to tredjedeler av utvalget hadde smerte. Beboerne med smerte hadde høyere gjennomsnittsskår for nevropsykiatriske symptomer og livskvalitet (høyere skår indikerer lavere livskvalitet) sammenliknet med beboerne uten smerte. Vi fant også sammenheng mellom det å ha smerte og høyere hjelpebehov for personnære aktiviteter i dagliglivet og høyere forekomst av depressive symptomer.
Konklusjon: Studien avdekker at smerte er et hyppig forekommende problem hos eldre sykehjemsbeboere med langtkommen demens. Våre funn indikerer at sykehjemsbeboere med langtkommen demens og smerte har større symptombyrde og lavere livskvalitet enn beboere uten smerte, noe som kan medføre tilleggsbehov for behandling, pleie og omsorg.
Referer til artikkelen
Rostad H, Grov E, Utne I, Halvorsrud L. Kjennetegn ved sykehjemsbeboere med langtkommen demens og smerter. Sykepleien Forskning. 2019;14(79184):e-79184. DOI: 10.4220/Sykepleienf.2019.79184
Mellom 80 000 og 100 000 personer i den norske befolkningen lever med demens, og blant dem som bor på sykehjem, er andelen med demens cirka 80 prosent (1). Demens kjennetegnes ved kognitiv svikt, som blant annet påvirker hvordan personen mottar, bearbeider og organiserer informasjon, og hvordan personen bruker språk og kommuniserer.
Vi graderer vanligvis demens i tre stadier: mild, moderat og langtkommen demens. Hos personer med langtkommen demens er evnen til å tenke logisk og ta hensiktsmessige avgjørelser vanligvis svært redusert (2). Forekomsten av komorbide lidelser, som hjerneslag, diabetes, kronisk hjertesvikt, Parkinson og osteoporose, med tilhørende symptomer som smerte, er høy blant eldre med demens (3).
Personer med langtkommen demens har ofte problemer knyttet til verbalt språk, enten til å finne ord eller forstå kompliserte utsagn. Det er én av årsakene som bidrar til at det ofte er mer komplekst både å vurdere og behandle smerter hos denne gruppen enn hos personer uten eller med mildere grad av demens.
Tidligere forskning
Studier fra norske sykehjem finner at smerte forekommer hos opptil 80 prosent (4, 5) av beboerne med demens, men det er lite forskning på hva som kjennetegner disse beboerne med smerte. Slik kunnskap vil kunne bidra til å identifisere konsekvenser av udekkede behov hos sykehjemsbeboere som lever med både demens og smerter.
Kunnskapen en slik studie fremskaffer, kan også informere helsepersonell om hvilke observasjoner og vurderinger de kan gjøre for å identifisere behov for behandling, pleie og omsorg, samt belyse det sammensatte sykdomsbildet og behovet til disse personene.
Forskning på kjønnsforskjeller knyttet til smerte er svært omfattende og inkluderer både kliniske og eksperimentelle studier (6) og mange ulike kliniske tilstander (7). Likevel er vårt inntrykk etter gjentatte litteratursøk at det er lite forskning på kjønnsforskjeller knyttet til smerte blant eldre og/eller personer med kognitiv svikt. Derfor har ikke studiene som vi henviser til her, utvalg av eldre med kognitiv svikt.
I en kritisk litteraturoppsummering konkluderer Fillingim og medarbeidere, på tvers av ulike kliniske tilstander som blant annet kreft, muskel–skjelett-smerter, ryggsmerter, abdominalsmerter og nevropatiske smerter, og eksperimentelle studier, at smerte ser ut til å forekomme hyppigere blant kvinner enn menn (7).
Smerteepidemiologien blant eldre er ikke godt forstått, og forekomsten av smerte blant eldre varierer betydelig mellom studier (8). Noen studier viser til økt forekomst av smerte ved økende alder, mens andre rapporterer det motsatte (9).
Det begrensede antallet studier fra sykehjem som inkluderer beboere med demens, antyder at det er en sammenheng mellom smerte og kliniske kjennetegn som nevropsykiatriske symptomer (NPS) (10), eksempelvis depressive symptomer (11) og agitasjon (12) og større hjelpebehov i dagliglivets aktiviteter (ADL) (13).
Men en systematisk forskningsoppsummering viser til svake sammenhenger mellom disse symptomene og smerter hos personer med demens (14). I tillegg kan redusert livskvalitet (15), redusert mobilitet, større grad av kognitiv svikt, bruk av psykoleptiske legemidler, bruk av fysiske tvangsmidler og manglende evne til verbal kommunikasjon ha sammenheng med smerte (16, 17), men kunnskapen er ufullstendig (17).
Hensikten med studien
Vi ønsket å undersøke hva det er som kjennetegner sykehjemsbeboere med langtkommen demens og smerte. Derfor hadde denne studien til hensikt å sammenlikne demografiske og kliniske kjennetegn mellom en gruppe beboere med smerter (heretter kalt «smertegruppen») og en gruppe beboere uten smerter (heretter kalt «ikke-smertegruppen»). Forskningsspørsmålene for studien var som følger:
- Hva er forekomsten av smerte blant eldre sykehjemsbeboere med langtkommen demens?
- Foreligger det statistisk signifikant forskjell mellom beboere med og uten smerte når det gjelder demografiske kjennetegn (kjønn og alder) og kliniske kjennetegn (ADL, NPS, depressive symptomer, somatisk helse, livskvalitet, agitasjon, bruk av smertestillende legemidler og psykoleptika)?
Metode
Studien er en kvantitativ, deskriptiv studie med et tverrsnittsdesign. Vi samlet inn dataene ved baseline i en større studie som undersøkte betydningen av regelmessig smertekartlegging for bruk av smertestillende legemidler og smerteskår hos sykehjemsbeboere med langtkommen demens (18).
Deltakere
I tilfeldig rekkefølge inviterte vi sykehjem i fire fylker på østlandsområdet til å delta i studien. Sykepleiere på de enkelte sykehjemmene identifiserte hvilke beboere som var aktuelle for å delta, i to trinn:
- Trinn 1: Sykepleierne inkluderte beboere som var 65 år og eldre, hadde langtkommen demens og ikke kunne selvrapportere smerte. Sistnevnte var en faglig vurdering gjort av sykepleieren ut fra vedkommendes kjennskap til beboeren. Beboere med korttidsopphold på sykehjem (<4 uker) ble ikke spurt om å delta i studien.
- Trinn 2: Sykepleierne kartla beboerne som ble inkludert i trinn 1. Dersom beboeren hadde smerte, agitasjon og/eller NPS av klinisk betydning, ble beboeren inkludert i studien. Smerte av klinisk betydning var definert som en skår ≥5 på Doloplus-2-smerteskalaen (19), agitasjon av klinisk betydning var definert som en skår ≥39 på Cohen-Mansfield Agitation Inventory (CMAI) (20), mens NPS av klinisk betydning var definert som en skår ≥4 (hyppighet x intensitet) på ett av spørsmålene i Neuropsychiatric Inventory-sykehjemsversjonen (NPI-NH) (21).
Sykepleierne inkluderte totalt 121 beboere i trinn 1, og ingen av beboerne ble ekskludert i trinn 2. Av de 121 beboerne som ble identifisert i trinn 1 og 2, ble totalt ni beboere ekskludert før datainnsamlingen startet: Én døde, to ble tatt ut av studien etter vurdering av sykepleieren, og ett sykehjem med seks beboere trakk seg fra studien.
Datainnsamling
Datainnsamlingen foregikk i perioden mars 2015 til juni 2016. Sykepleierne ved de enkelte sykehjemmene brukte et standardisert skjema til å samle demografiske data, blant annet kjønn og alder, og validerte kartleggingsverktøy til å samle inn kliniske data om deltakende beboere. Sykepleierne brukte kartleggingsverktøy basert på observasjon til å samle inn data om følgende:
- Forekomst av smerte ble målt med Doloplus-2-smerteskalaen (19). Skalaen består av ti spørsmål som skåres fra 0 til 3, der 0 indikerer at atferden som vurderes, er «som vanlig» eller «fraværende», mens 3 er den høyeste skåren for atferden. Totalskåren varierer fra 0 til 30. En skår på ≥5 indikerer smerte (19). Smerteskår på ≥5 ble brukt til å dele utvalget i to grupper: «smertegruppen» (skår ≥5) og «ikke-smertegruppen» (skår ≤4).
- Depressive symptomer ble målt med Cornell-depresjonsskalaen (22), som består av 19 spørsmål som skåres på følgende måte: 0 = ikke til stede, 1 = moderat eller bare til stede periodevis, 2 = mye til stede, og a = lar seg ikke evaluere. Skårene på enkeltspørsmål ble lagt sammen til en totalskår, der skår på ≤4 indikerer ingen depressiv episode, 7–11 indikerer mulig mild depressive episode, ≥12 indikerer moderat til alvorlig depressiv episode (22).
- Nevropsykiatriske symptomer ble målt med NPI-NH (23). Dersom atferden eller symptomet er til stede, vurderes hyppighet (fra 1 = sjelden til 4 = veldig ofte) og intensitet (1 = mild, 2 = moderat, 3 = alvorlig). For hvert atferdstrekk eller symptom regnes det ut en delskår (hyppighet x intensitet), som igjen summeres for de 10 første spørsmålene. NPI-NH består av tolv spørsmål, men «Søvn» og «Appetitt og spiseforstyrrelse» er ikke medregnet i totalskåren i denne studien. Skårområdet ( score range) er derfor fra 0–120.
- Agitasjon ble målt med CMAI, der 29 agiterte atferdstyper skåres fra 1 = aldri til 7 = flere ganger i timen (24). Totalskåren varierer fra 29–203.
- Personnære aktiviteter i dagliglivet (p-ADL) ble målt med ADL-vurdering, personnære aktiviteter i dagliglivet (25). Seks aktiviteter skåres fra 0 = ikke aktuelt og 1 = total uavhengighet til 5 = total avhengighet for å beskrive personens hjelpebehov. I denne studien ble skårene for hvert enkelt spørsmål summert for å oppnå en totalskår. Vi brukte en grenseverdi på ≥18 (skår ≥3 på de enkelte elementene) for å indikere moderat til høyt hjelpebehov.
- Livskvalitet ble målt med Livskvalitet ved langtkommen demensskala (QUALID, the quality of life in late-stage dementia) (26), som består av elleve påstander som vurderes på en fempunkts skala fra 1 = aldri/sjelden til 5 = det meste av dagen / en eller flere ganger daglig. Totalskåren går fra 11–55, hvor lavere skår indikerer høyere livskvalitet.
- Somatisk helse (medisinsk komorbiditet) ble målt med General Medical Health Rating (27). Beboerens nåværende og tidligere medisinske historie utenom demenssykdommen tilegnes en kategori mellom 1 og 4 (1 = utmerket, 2 = bra, 3 = moderat og 4 = dårlig).
- Bruk av smertestillende legemidler og psykoleptika ble hentet fra beboerens medisinliste som vi hadde fått anonymisert kopi av. Fast bruk av smertestillende legemidler (ACT-kode N02A og N02B), psykoleptika (ATC-kode N05) og antidepressiver (ATC-kode N06A) er en kategorisk variabel: ja/nei. Vi har også med en kontinuerlig variabel for dose målt i milligram per døgn for paracetamol og orale morfinekvivalenter når alle opioider, uavhengig av virkestoff og form, er samlet i en fellesbetegnelse. Med det mener vi den mengden morfin som doseringen tilsvarer dersom morfin ble gitt som tabletter.
Analyse
Analyser av data er gjort i SPSS versjon 25 (IBM Corp., Armonk, NY, USA). Vi presenterer kontinuerlige variabler med gjennomsnitt og standardavvik (SD), mens frekvens og relativ frekvens i prosent presenteres for kategoriske variabler. Vi brukte t-test for uavhengige utvalg for å sammenlikne smertegruppen med ikke-smertegruppen for kontinuerlige variabler. For kategoriske variabler brukte vi kjikvadrattest.
Etikk
Deltakerne i denne studien hadde langtkommen demens. Derfor innhentet vi skriftlig samtykke fra beboernes nærmeste familie før studiestarten. Studien er godkjent av Regionale komitéer for medisinsk og helsefaglig forskningsetikk (REK sør-øst, referansenummer 2014/1431).
Resultat
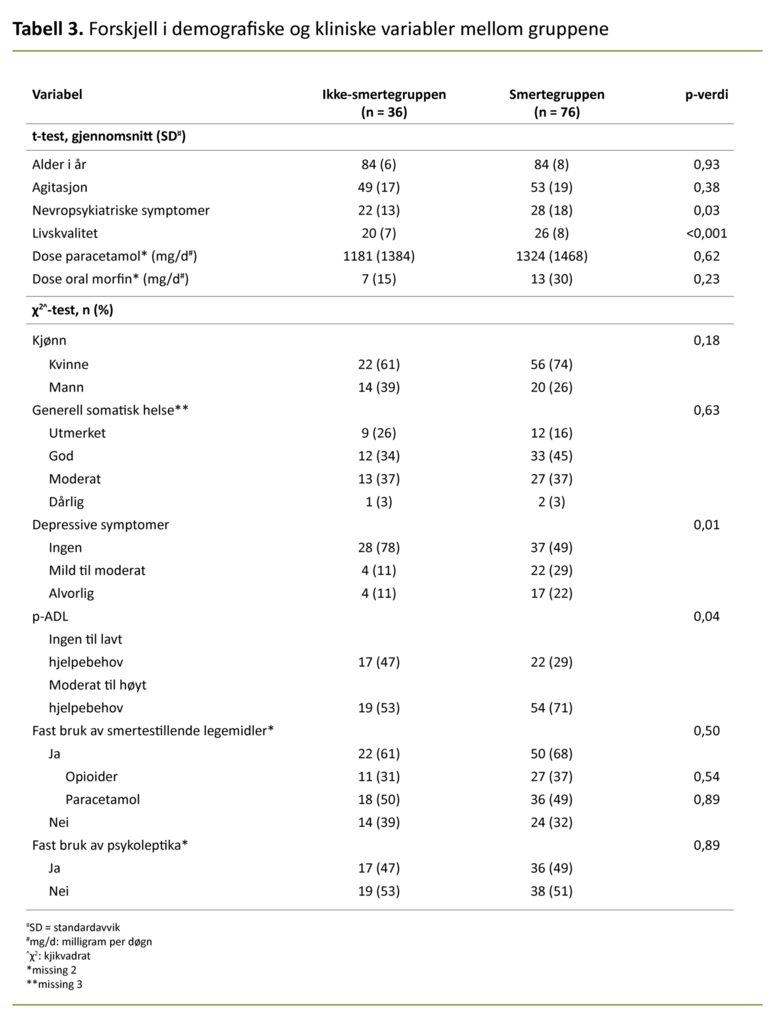
Totalt deltok 112 sykehjemsbeboere fra 16 sykehjem i studien. Gjennomsnittsalderen for hele utvalget var 84 år, og 70 prosent var kvinner. Ytterligere beskrivelse av utvalget er gitt i tabell 1. Et av hovedfunnene er at kartleggingen med Doloplus-2 tilsa at to tredjedeler av utvalget hadde smerte. Se tabell 2 for informasjon om forekomsten av smerte og bruken av smertestillende legemidler.
I tabell 3 presenterer vi forskjellen mellom smertegruppen og ikke-smertegruppen med tanke på kliniske og demografiske variabler. Et annet hovedfunn er at gjennomsnittsskåren for NPS og livskvalitet (høyere skår indikerer lavere livskvalitet) er høyere i smertegruppen enn ikke-smertegruppen. Vi fant en sammenheng mellom smerte og høyere hjelpebehov i p-ADL og forekomsten av depressive symptomer.
Diskusjon
Forekomsten av smerte blant sykehjemsbeboere med langtkommen demens var høy. To av tre beboere ble vurdert til å ha smerte. Dette er ikke noe nytt, og det samsvarer med tidligere forskning fra norske sykehjem som har undersøkt forekomsten av smerte hos personer med langtkommen demens på sykehjem (4).
Resultatet viser at en tredjedel av beboerne som ble vurdert til å ha smerte, ikke fikk smertestillende på fast basis. Det betyr ikke at beboerne ikke fikk noen smertelindring, for de kan ha fått smertestillende legemidler ved behov, eller det kan ha blitt iverksatt ikke-medikamentelle tiltak. Det er også interessant å merke seg at to tredjedeler av beboerne som ble vurdert til å ha smerte, fikk smertestillende fast.
Selv om en person får smertestillende legemidler på fast basis, er det ingen selvfølge at behandlingen er tilfredsstillende. At så mange blir vurdert til å ha smerte til tross for at de bruker smertestillende legemidler fast, kan være en indikasjon på akkurat det – at smertelindringen var utilstrekkelig.
Smertegruppen hadde lavere livskvalitet
Våre resultater viser at smertegruppen har høyere gjennomsnittskår for NPS sammenliknet med ikke-smertegruppen, og at det er sammenheng mellom det å ha smerte og høyere hjelpebehov i p-ADL og høyere forekomst av depressive symptomer. Økt hjelpebehov i p-ADL er et av kriteriene for diagnostisering av demens (28) og er en av de vanligste årsakene til at personer med demens flytter fra hjem til sykehjem (29).
Videre er nevropsykiatriske, derav depressive symptomer, hyppig forkommende blant eldre sykehjemsbeboere med demens (30, 31). Derfor var det rimelig å anta at mange i vårt utvalg ville ha behov for hjelp for å ivareta grunnleggende p-ADL og/eller ha nevropsykiatriske og depressive symptomer, uavhengig av om de har smerte eller ikke.
Likevel fant vi at smertegruppen hadde betydelig større belastning knyttet til fysiske og psykiske symptomer og helseutfordringer sammenliknet med ikke-smertegruppen. Våre resultater, med støtte i tidligere forskning (10, 11, 13), indikerer dermed at smerte henger sammen med økt byrde av NPS og depressive symptomer og høyere hjelpebehov i p-ADL.
Dette funnet er av betydning for et annet viktig funn i denne studien: at smertegruppen har lavere livskvalitet sammenliknet med ikke-smertegruppen. En tidligere studie viste at smerte har en direkte effekt på livskvaliteten til sykehjemsbeboere med langtkommen demens, men at sammenhengen mellom smerte og livskvalitet delvis forklares gjennom NPS, depressive symptomer og p-ADL (15).
At smertegruppen har lavere livskvalitet sammenliknet med ikke-smertegruppen, kan da muligens forklares av den observerte forskjellen i NPS, depressive symptomer og hjelpebehov i p-ADL, og ikke kun av smerte i seg selv.
Lik bruk av legemidler
Det var ingen forskjell på gruppene når det gjelder fast bruk av psykoleptiske eller smertestillende legemidler, eller i gjennomsnittlig dose smertestillende legemidler (mg/døgn), verken for paracetamol eller orale morfinekvivalenter. En mulig forklaring kan være at psykoleptika, særlig antidepressiver, er hyppig anvendt blant beboere med demens (32).
Det samme gjelder for paracetamol (33). I tillegg har bruken av smertestillende legemidler, hovedsakelig paracetamol og sterke opioider, økt kraftig blant eldre fra tidlig på 2000-tallet og frem mot i dag (33).
Ingen sammenheng mellom smerte og alder, kjønn eller somatisk helse
Tidligere forskning har vist at demografiske variabler som kjønn og alder er av betydning for smerte (7, 9), men i vårt utvalgt var det ingen forskjell i alder mellom smertegruppen og ikke-smertegruppen, ei heller var det en sammenheng mellom smerte og kjønn. Vi fant heller ingen sammenheng mellom smerte og somatisk helse.
Flertallet av beboerne med smerte ble faktisk vurdert til å ha utmerket til god somatisk helse – de hadde ingen eller kun én ustabil somatisk sykdomstilstand, brukte fire eller færre medikamenter og fremsto som friske eller kun litt sykdomspreget (27).
Vi fant heller ingen statistisk signifikant forskjell mellom beboerne med og uten smerte for gjennomsnittlig agitasjonsskår. Resultater fra tidligere forskning på sammenhengen mellom smerte og agitasjon hos personer med demens er inkonsekvent.
Habiger og medarbeidere gjennomførte en klusterrandomisert, kontrollert studie og fant at smertebehandling førte til redusert agitasjonsskår, som indikerer at smerte er den underliggende årsaken til agitasjon (12).
Imidlertid fant ikke blant andre Sampson og medarbeidere noen sammenheng mellom smerte og agitasjon i sine longitudinelle studier (34). I tillegg er agitasjon et sammensatt begrep som inneholder et bredt spekter av faktorer, og det kan være at noen av spørsmålene i CMAI er sterkere assosiert med smerte enn andre (34).
Styrker og begrensninger
En av studiens styrker er at vi anvendte anerkjente, validerte og reliable kartleggingsinstrumenter. Samtidig er smerte en subjektiv opplevelse. Derfor er det viktig å erkjenne at bruken av kartleggingsinstrumenter som er basert på observasjon av atferd og ikke beboernes selvrapport, kan være utilstrekkelige og til og med medføre en feilaktig fremstilling av beboernes smerteopplevelse.
Likevel er det, så langt, ingen annen veletablert vurderingsmetode som fremstår som bedre enn observasjonstilnærmingen som er brukt i denne studien. En annen begrensing er at grenseverdien (Doloplus-2 ≥5) som ble brukt til å dele utvalget inn i smertegruppen og ikke-smertegruppen, ikke er validert – den er kun basert på instrumentutviklernes kliniske erfaring.
Det er også en begrensning at flere av de observasjonsbaserte kartleggingsinstrumentene vi brukte, har overlappende spørsmål. Overlappende atferdsmessige uttrykk observert for blant annet smerte, depressive symptomer og demens gjør det vanskelig for helsepersonell å skille mellom disse symptomene i klinisk praksis.
En annen svakhet er at vi ikke kan gi et komplett bilde av smertelindringen gitt til beboerne da vi ikke har data om smertestillende legemidler administrert ved behov eller ikke-medikamentelle tiltak mot smerte.
Det er en styrke at utvalgets demografiske karakteristika er sammenliknbare med tilsvarende større norske studier på feltet. Overføringsverdien av funnene i denne studien til beboere ved andre sykehjem må vurderes i lys av begrensningen i utvalget, som kun er representert av 112 beboerne fra 16 sykehjem på Østlandet.
At dataene som ble analysert, kun var fra ett tidspunkt, begrenser oss fra å kunne kommentere på årsakssammenheng. Selv om vi fant statistisk signifikante forskjeller mellom smertegruppen og ikke-smertegruppen, er ikke det ensbetydende med at det er vesentlig forskjell på gruppene klinisk sett.
Implikasjoner
Smerte er et hyppig forekommende problem hos sykehjemsbeboere med langtkommen demens. Vår studie indikerer at belastningen av nevropsykiatriske og depressive symptomer øker ved smerte. I tillegg reduseres beboerens p-ADL-funksjon og livskvalitet når beboeren har smerte. Derfor er gjenkjennelse av smerte og effektiv smertebehandling en viktig oppgave for helsepersonell fordi sykehjemsbeboeren med smerte har mer belastende symptomer og helseproblemer sammenliknet med beboeren uten smerter.
Systematisk kartlegging av sykehjemsbeboere med langtkommen demens er avgjørende fordi det kan gi helsepersonell føringer for videre observasjoner og vurderinger og hjelpe til med å identifisere hvilke beboere som har behov for tiltak.
Longitudinelle studier av sykehjemsbeboere med smerte vil gi viktig informasjon om hvordan smerte over tid påvirker p-ADL, depressive symptomer, NPS og livskvalitet. Det kan bidra til å utforme mer effektive tiltak og samtidig unngå unødige eller skadelige tiltak, som igjen skaper et potensial for mer hensiktsmessig bruk av knappe ressurser.
Et annen interessant område for videre forskning kan være å undersøke symptomknipper – tre eller flere samtidige symptomer som er relaterte, men ikke nødvendigvis av samme bakenforliggende årsak.
Som resultatet i vår studie indikerer, har ikke sykehjemsbeboeren med langtkommen demens og smerte ett enkelt symptom eller helseproblem, men i stedet et komplekst lidelsesbilde med mange sykdommer og symptomer i tillegg til redusert evne til å kommunisere verbalt.
Konklusjon
Vår studie indikerer at smerte hos eldre sykehjemsbeboere med langtkommen demens er et utbredt problem som har innvirkning på fysiske og psykiske symptomer og andre helseutfordringer. Våre resultater viser at sykehjemsbeboere med langtkommen demens og smerter har høyere gjennomsnittsskår for NPS sammenliknet med beboerne uten smerter, og at det er sammenheng mellom det å ha smerte og hjelpebehov i p-ADL, og forekomsten av depressive symptomer.
I tillegg indikerer våre funn at sykehjemsbeboere med langtkommen demens og smerter har lavere livskvalitet enn beboerne uten smerter. Systematisk kartlegging av smerte og andre symptomer og helseproblemer hos sykehjemsbeboere med langtkommen demens er derfor en viktig oppgave for helsepersonell, og et etisk og faglig ansvar som kan bidra til mer effektiv og riktig behandling, pleie og omsorg.
Vi opplyser om at Hanne Marie Rostad er assisterende redaktør i Sykepleien Forskning. Artikkelen ble godkjent før hun ble assisterende redaktør.
Referanser
1. Grøholt E, Bøhler L, Hånes H. Folkehelserapporten – helsetilstanden i Norge i 2018. Oslo: Folkehelseinstituttet; 2018.
2. Verdens helseorganisasjon, Alzheimer’s Disease International. Dementia. A Public Health Priority. Genéve; 2012. Tilgjengelig fra: https://apps.who.int/iris/bitstream/handle/10665/75263/9789241564458_eng.pdf;jsessionid=AF546989FADC48F521DA310293FFCFF3?sequence=1 (nedlastet 16.10.2019).
3. Bunn F, Burn A-M, Goodman C, Rait G, Norton S, Robinson L, et al. Comorbidity and dementia: a scoping review of the literature. 2014;12(1):192.
4. Torvik K, Kaasa S, Kirkevold Ø, Rustøen T. Pain in patients living in Norwegian nursing homes. Palliative Medicine. 2009;23(1):8–16.
5. Husebø BS, Strand LI, Moe‐Nilssen R, Husebo SB, Ljunggren AE. Pain in older persons with severe dementia. Psychometric properties of the Mobilization-Observation-Behaviour-Intensity-Dementia (MOBID‐2) Pain Scale in a clinical setting. Scandinavian Journal of Caring Sciences. 2010;24(2):380–91.
6. Bartley EJ, Fillingim RB. Sex differences in pain: a brief review of clinical and experimental findings. British Journal of Anaesthesia. 2013;111(1):52–8.
7. Fillingim RB, King CD, Ribeiro-Dasilva MC, Rahim-Williams B, Riley J. Sex, gender, and pain: a review of recent clinical and experimental findings. The Journal of Pain. 2009;10(5):447–85.
8. Patel KV, Guralnik JM, Dansie EJ, Turk DC. Prevalence and impact of pain among older adults in the United States: findings from the 2011 National Health and Aging Trends Study. 2013;154(12):2649–57.
9. Jones G, Macfarlane G. Epidemiology of pain in older persons. I: Gibson S, Weiner D, red. Pain in older persons. Seattle: IASP Press; 2005.
10. Husebø BS, Ballard C, Sandvik R, Nilsen OB, Aarsland D. Efficacy of treating pain to reduce behavioural disturbances in residents of nursing homes with dementia: cluster randomised clinical trial. BMJ. 2011;343:d4065.
11. Erdal A, Flo E, Selbaek G, Aarsland D, Bergh S, Slettebo DD, et al. Associations between pain and depression in nursing home patients at different stages of dementia. Journal of Affective Disorders. 2017;218:8–14.
12. Habiger TF, Flo E, Achterberg WP, Husebo BS. The interactive relationship between pain, psychosis, and agitation in people with dementia: results from a cluster-randomised clinical trial. Behavioural Neurology. 2016; artikkel-ID 7036415. DOI: 10.1155/2016/7036415
13. Cadogan MP, Edelen MO, Lorenz KA, Jones M, Yosef J, Hascall T, et al. The relationship of reported pain severity to perceived effect on function of nursing home residents. The Journals of Gerontology. Series A: Biological Sciences and Medical Sciences. 2008;63(9):969–73.
14. van Dalen-Kok AH, Pieper MJ, de Waal MW, Lukas A, Husebo BS, Achterberg WP. Association between pain, neuropsychiatric symptoms, and physical function in dementia: a systematic review and meta-analysis. BMC Geriatrics. 2015;15(1):49.
15. Rostad HM, Puts MT, Småstuen MC, Grov EK, Utne I, Halvorsrud L. Associations between pain and quality of life in severe dementia: a Norwegian cross-sectional study. Dementia & Geriatric Cognitive Disorders Extra. 2017;7(1):109–21.
16. Miu D, Chan K, Geriatrics. Under-detection of pain in elderly nursing home residents with moderate to severe dementia. Journal of Clinical Gerontology. 2014;5(1):23–7.
17. Takai Y, Yamamoto-Mitani N, Okamoto Y, Koyama K, Honda A. Literature review of pain prevalence among older residents of nursing homes. Pain Management Nursing. 2010;11(4):209–23.
18. Rostad HM, Utne I, Grov EK, Småstuen MC, Puts M, Halvorsrud L. The impact of a pain assessment intervention on pain score and analgesic use in older nursing home residents with severe dementia: A cluster randomised controlled trial. International Journal of Nursing Studies. 2018;84:52–60.
19. Lefebvre-Chapiro S. The DOLOPLUS-2 scale – evaluating pain in the elderly. European Journal of Palliative Care. 2001;8(5):191–4.
20. Husebø BS, Ballard C, Cohen-Mansfield J, Seifert R, Aarsland D. The response of agitated behavior to pain management in persons with dementia. The American Journal of Geriatric Psychiatry. 2014;22(7):708–17.
21. Selbæk G, Kirkevold Ø, Engedal K. The prevalence of psychiatric symptoms and behavioural disturbances and the use of psychotropic drugs in Norwegian nursing homes. International Journal of Geriatric Psychiatry. 2007;22(9):843–9.
22. Alexopoulos GS, Abrams RC, Young RC, Shamoian CA. Cornell scale for depression in dementia. Biological Psychiatry. 1988;23(3):271–84.
23. Cummings JL, Mega M, Gray K, Rosenberg-Thompson S, Carusi DA, Gornbein J. The Neuropsychiatric Inventory comprehensive assessment of psychopathology in dementia. Neurology. 1994;44(12):2308.
24. Cohen-Mansfield J. Conceptualization of agitation: results based on the Cohen-Mansfield agitation inventory and the agitation behavior mapping instrument. International Psychogeriatrics. 1997;8(S3):309–15.
25. Lawton M, Brody E. Assessment of older people: self-maintaining and instrumental activities of daily living. Nursing Research. 1970;19(3):278.
26. Weiner MF, Martin-Cook K, Svetlik DA, Saine K, Foster B, Fontaine C. The quality of life in late-stage dementia (QUALID) scale. Journal of the American Medical Directors Association. 1999;1(3):114–6.
27. Lyketsos CG, Galik E, Steele C, Steinberg M, Rosenblatt A, Warren A, et al. The General Medical Health Rating: a bedside global rating of medical comorbidity in patients with dementia. Journal of the American Geriatrics Society. 1999;47(4):487–91.
28. Direktoratet for e-helse, Verdens helseorganisasjon. ICD-10: Den internasjonale statistiske klassifikasjonen av sykdommer og beslektede helseproblemer [internett]. Oslo: 2019 [oppdatert 12.08.2019; sitert 16.10.2019]. Tilgjengelig fra: https://ehelse.no/standarder/ikke-standarder/icd-10-den-internasjonale-statistiske-klassifikasjonen-av-sykdommer-og-beslektede-helseproblemer
29. Verbeek H, Meyer G, Challis D, Zabalegui A, Soto ME, Saks K, et al. Inter‐country exploration of factors associated with admission to long‐term institutional dementia care: evidence from the RightTimePlaceCare study. Journal of Advanced Nursing. 2015;71(6):1338–50.
30. Selbæk G, Engedal K, Bergh S. The prevalence and course of neuropsychiatric symptoms in nursing home patients with dementia: a systematic review. Journal of the American Medical Directors Association. 2013;14(3):161–9.
31. Iden KR, Engedal K, Hjorleifsson S, Ruths S. Prevalence of depression among recently admitted long-term care patients in Norwegian nursing homes: associations with diagnostic workup and use of antidepressants. Dementia & Geriatric Cognitive Disorders. 2014;37(3–4):154–62.
32. Helvik A-S, Benth JŠ, Wu B, Engedal K, Selbæk G. Persistent use of psychotropic drugs in nursing home residents in Norway. BMC Geriatrics. 2017;17(1):52.
33. Berg C, red. Reseptregisteret 2013–2017. Legemiddelstatistikk 2018:2, Oslo: Folkehelseinstituttet; 2018. Tilgjengelig fra: https://www.fhi.no/globalassets/dokumenterfiler/rapporter/2018/reseptregisteret-2013_2017-temadel-om-legemidler-og-eldre.pdf (nedlastet 16.10.2019).
34. Sampson EL, White N, Lord K, Leurent B, Vickerstaff V, Scott S, et al. Pain, agitation, and behavioural problems in people with dementia admitted to general hospital wards: a longitudinal cohort study. Pain. 2015;156(4):675.





















Kommentarer