Pasienter med livstruende blødning bør få fullblod
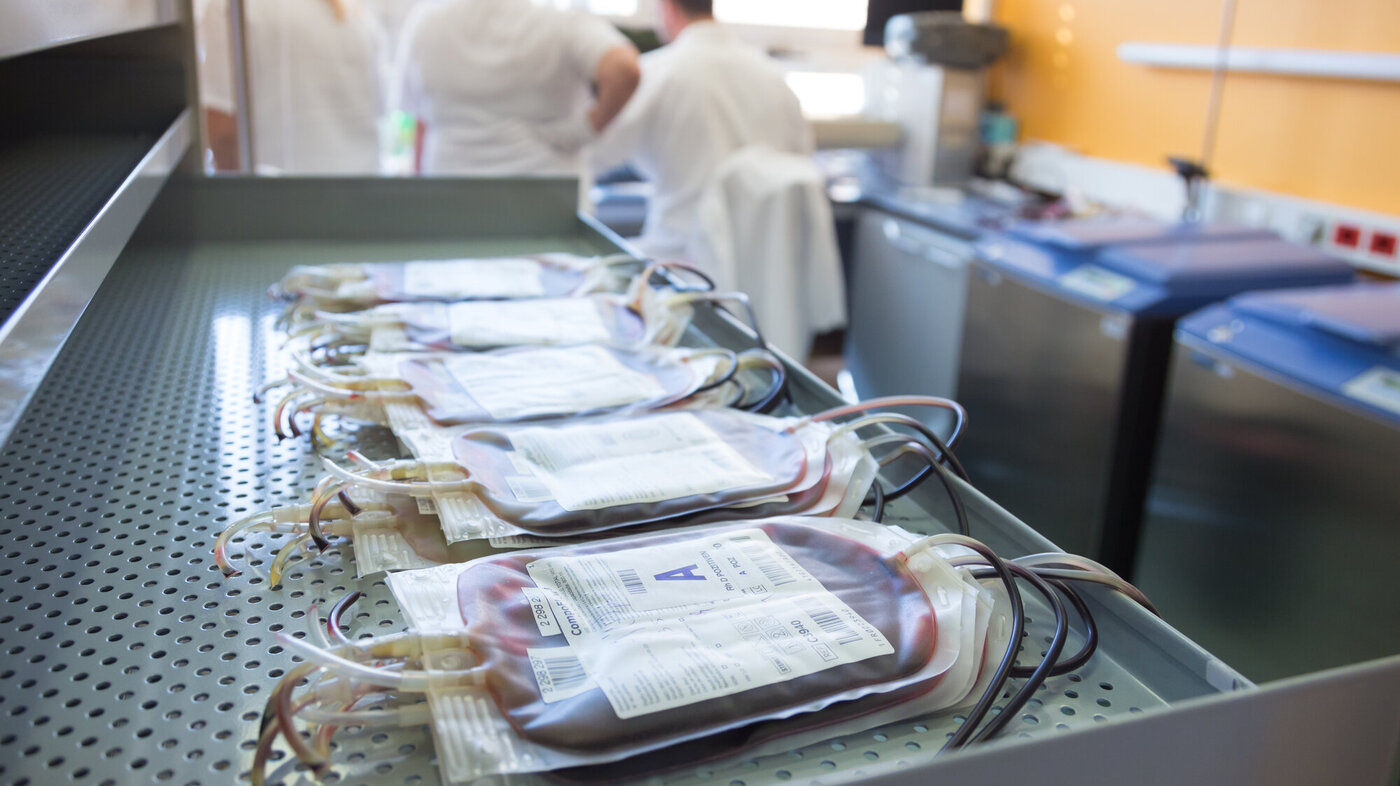
Dagens gullstandard med blodkomponentterapi stjeler av pasientenes tid ved massiv blødning. Derfor har stadig flere akuttmiljøer begynt å gi dem fullblod.
Er det på tide å ta tilbake glemt kunnskap og tenke annerledes om transfusjon ved livstruende blødning? I denne fagartikkelen diskuterer vi om transfusjonsbehandling med fullblod bør erstatte blodkomponentterapi for akutte og kritisk syke pasienter.
Se for deg et scenario. Du er sykepleier i akuttmottaket på et middels stort regionalt sykehus. Det er natt til lørdag, og avdelingen er travel. Oppmerksomheten din er delt mellom pasienten med brystsmerter, en eldre kar med hoftebrudd og en ung dame med mistenkt urosepsis.
Traumealarmen går. En pasient har livstruende blødning
Det passer svært dårlig at traumealarmen går. En ung MC-fører har truffet autovernet i høy hastighet. Ulykken har skjedd i nærheten av sykehuset, og pasienten fremstår som alvorlig skadd med redusert bevissthet, klam og blek hud, ikke palpabel radialispuls. Ambulansepersonellet har valgt en load and go-tilnærming, og pasienten er ventet inn om tre minutter.
Du ser det med én gang: Det er noe unaturlig ved måten gutten ligger på. Han ligger med øynene åpne, men møter ikke blikket ditt og svarer ikke. Huden er ikke blek. Du synes han heller fremstår som ubestemmelig grå. Og leppene mangler farge. Du ser at pasienten puster, men du mister tellingen – det går fort. Du kjenner din egen puls øke og blir litt uvel. Litt redd egentlig. «Takler jeg dette? Hvem har jeg å spille på?», farer det gjennom hodet ditt.
Anestesilegen, som er lun og blid til vanlig, fremstår annerledes nå, hektisk og krass i stemmen. Anestesisykepleieren jobber med raske bevegelser, hun skjelver på hendene og mister ting i gulvet. Den roen anestesipersonellet vanligvis har, er ikke der i natt. Du forstår alvoret i situasjonen, og det gjør deg om mulig enda mer redd.
Du klipper opp klær og henter varme tepper. Det kommer mange beskjeder, og de kommer samtidig: «Aktiver massiv transfusjonsprotokoll!», «Jeg får ikke målt blodtrykket! Vil du hente en ny mansjett?», «Klargjør til transfusjon!», «Kan du lage et arterietrykksett?», «Har vi flere blodvarmere?», «Er blodet sjekket?»
Anestesisykepleieren sliter med å finne blodårer. Det er ingenting å se, ingenting å kjenne. Pasienten er for kald og for dårlig sirkulert. «Vi legger intraossøs kanyle», sier anestesilegen. Anestesisykepleieren finner frem utstyret til dette. «Er transfusjon i gang?», hører du teamlederen si. «Nei, vi jobber fortsatt med innganger», hører du anestesilegen svare, litt skarpere nå.
Røntgenbildene viser pneumotoraks og bekkenfraktur. Ultralyd viser fri væske i toraks og abdomen. Alt tyder på livstruende og pågående blødning. «Sjekker du blod med meg?», spør anestesisykepleieren. Blikket hennes er matt. Dere vet det begge to – her kommer dere til kort.
Pasienten får en balansert transfusjon
Dere har fire enheter O RhD-negativt erytrocyttkonsentrat (SAG) tilgjengelig. Posene kontrolleres og henges opp, en etter en. Innen plasma er tint og trombocyttene ankommet, har alle fire SAG-enhetene gått inn. På sykehuset ditt består en massiv transfusjonspakke (MTP) av fire poser med erytrocyttkonsentrat (SAG), fire poser med plasma (Octaplas) og ett trombocyttkonsentrat (fra fire givere).
Du vet at posene skal gis som balansert transfusjon, det vil si i forholdet 1:1:1. Du har lært at balansert transfusjon må til for å sikre hemostase og oksygenleveranse til cellene samt for å forebygge og snu traumeindusert koagulopati (TIC, trauma induced coagulopathy).
Det holder ikke med volum. Du vet også at enhver forsinkelse i transfusjonen stjeler av pasientens tid. Du har tidligere erfart at det kreves minst en og helst to personer som har dobbeltkontroll, dokumentasjon og administrering av blodprodukter som sin eneste oppgave.
Et toraksdren blir anlagt, og det kommer blod i kammeret – mye blod. Pasienten kjøres nå til operasjonsstuen, du får beskjed om å bli med. Jobben din blir å administrere og holde oversikt over blodproduktene. Anestesisykepleieren og anestesilegen har hendene fulle med å balansere narkose, svært ustabil hemodynamikk og vanskelige ventilasjonsforhold.
Medisinske uttrykk er forklart i en ordliste nederst i artikkelen.
Massiv blødning gir mange utfordringer
Overdrevet? På ingen måte! Massiv blødning uansett årsak, det være seg traumatiske skader eller komplikasjoner i forbindelse med fødsel, kirurgi og medisinske tilstander, fører med seg mange av de samme utfordringene. Et stort antall oppgaver skal gjennomføres samtidig. En slik setting kan utarte til å bli uoversiktlig og utfordre teammedlemmene faglig, fysisk, psykisk og sosialt. Både tekniske og ikke-tekniske ferdigheter kan settes på prøve (1).
Pressede situasjoner preges av samtidighetskonflikter, vanskelige prioriteringer, raske kliniske avgjørelser og situasjoner som involverer et stort antall profesjonelle aktører. Det er gjerne i slike situasjoner at oppmerksomhet fragmenteres, konsentrasjon svekkes, kommunikasjon i teamet bryter sammen og uønskede hendelser oppstår (2, 3).
Mer enn én gang har jeg undret meg: Finnes det en annen måte å gjøre dette på? Det viser seg at det gjør det! Første gangen jeg hørte om transfusjonsbehandling med fullblod, var på et kurs i hemostatisk nødkirurgi på Haukeland universitetssjukehus. Dette var tilbake i 2018. Litt pinlig kanskje, men ikke så rart. Blodkomponentterapi har nemlig vært enerådende transfusjonspraksis i Norge i omtrent 30 år (8).
Den som blør fullblod, bør få fullblod
Å tappe giveren for fullblod, for så å dele blodet i erytrocyttkonsentrat, trombocyttkonsentrat og plasma, er standard praksis i den industrialiserte verdenen (4, 5). Ved å oppbevare komponentene separat, forlenges holdbarheten. Ikke minst utnyttes en verdifull ressurs på best mulig måte: Pasienten med anemi får erytrocytter, kreftpasienten får trombocytter, og pasienten med koagulasjonsforstyrrelser får plasma. Smart, fornuftig og etisk forsvarlig. Ikke minst i tråd med styrende anbefalinger: Restriksjon skal utvises, og transfusjon skal gjennomføres på indikasjon – rett blodkomponent til rett pasient til rett tid (6, 7).
Pasienter med akutt og ukontrollert blodtap blør verken saltvann eller blodkomponenter. Pasienten blør fullblod og kan gjerne få fullblod tilbake. Dette er ingen ny vitenskap. Det viser seg at fullblod ble benyttet i stor skala til transfusjoner under første og andre verdenskrig samt i Korea- og Vietnamkrigen. I 30- og 40-årene begynte fraksjoneringen av plasma og albumin – en innovasjon som ble drevet frem av krig og behovet for å frakte blodbestanddeler over lange avstander (4, 8, 9).
På 60- og 70-tallet økte behovet for separate blodkomponenter grunnet stadig mer avansert pasientbehandling. Fraksjoneringen ble enklere, og komponentene holdt god kvalitet under stadig lengre lagringstid. Fremstillingen av fullblod til transfusjon avtok gradvis. I løpet av 90-tallet ble komponentterapi en akseptert gullstandard i industriland (8, 10).
Flere utviklingsland manglet ressurser og teknologi til å gjennomføre praksisendringen og har fullblod som eneste transfusjonsalternativ den dag i dag (4, 5). Det er verdt å merke seg at kliniske studier uteble, som kunne påvise like godt eller forbedret pasientutfall ved bruk av komponenter sammenliknet med fullblod (11, 12).
Fra begynnelsen av 2000-tallet har oppmerksomheten økt på å behandle hypovolemisk sjokk ved hjelp av blodprodukter. Nok en gang ble forskningen drevet frem av krig og militære behov, denne gangen grunnet konflikter i Irak og Afghanistan (4). I tillegg til utstrakt bruk i militær sektor i USA, Israel og Norge brukes fullblod i økende omfang til sivilbefolkningen, både nasjonalt og internasjonalt, prehospitalt som inhospitalt (4, 13–15).
Fullblod ved massiv blødning gir mindre stress
Tenk deg tilbake til natta i mottak. Se for deg at det ligger O RhD-negativt fullblod i stedet for O RhD-negativt SAG i kjølebagen. I dette scenarioet består en MTP av fire enheter fullblod. Det vil si fire poser, og ikke ni, som skal kontrolleres, klargjøres og administreres. Det greier seg med én god intravenøs inngang til å begynne med. Ett transfusjonssett. Ingen venting på trombocytter og plasma. Jobben er overkommelig, stress- og støynivået på stua holdes nede.
Fire enheter fullblod tilfører pasienten omtrent 2000 ml volum uten nevneverdig forsinkelsestid. Et minimum av tilsatt antikoagulantløsning gjør fortynningseffekten liten. Balanse sikres fra første minutt av påstartet transfusjon (16, 17).
Ikke minst gjør fullblod det mulig å tilby balansert transfusjon prehospitalt i luftambulanser og andre legebemannet utrykningskjøretøy (15, 18). Små og avsidesliggende sykehus uten trombocyttberedskap har per i dag ingen tilbud om balansert transfusjon. Det er fullt mulig å tilstrebe gjennom å etablere et fullblodsprogram (16–18).
Innebærer dagens praksis en prioritering på villspor?
Det er her det begynner å bli problematisk. Et likeverdig tilbud av helsetjenester er en villet helsepolitisk utvikling. En variasjon i tjenestetilbud betegnes som uønsket dersom den ikke kan forklares av ulikheter i demografi, geografi, sykelighet eller andre forhold som sykehusene ikke kan gjøre noe med (19).
Omfanget av prehospital mortalitet ved massiv blødning er godt dokumentert. Forskning viser at mortaliteten øker med fem prosent for hvert minutt av en forsinket transfusjon (20). Pasienter med akutte og livstruende blødninger blir i dag tilbudt ulik behandling ut fra hvor i landet de befinner seg på skadetidspunktet. Per dags dato bærer luftambulansetjenesten i Trondheim, Bergen, Førde og Innlandet fullblod om bord (15).
I tillegg finnes det muligheter for intrahospital fullblodstransfusjon ved enkelte sykehus, deriblant Haukeland, Voss, Førde og Tynset. Noen sykehus er i planleggingsfasen, mens andre er i innspurten av å sikre et godt transfusjonstilbud til sine pasienter. Dette er opplysninger jeg har fått i privat korrespondanse.
Transfusjonsrisikoen økte ikke ved fullblod
Disse forskjellene i pasientbehandling vekket min nysgjerrighet. Dersom fullblod er det optimale transfusjonsalternativet ved større blodtap, bør ikke også pasienter ved mitt arbeidssted ha et likeverdig tilbud? Og hvis de bør det, hva skal til for å få det?
Dette ble bakgrunnen for min masteravhandling. I tidsrommet 2020–2021 gjennomførte jeg en systematisk litteraturstudie for å kartlegge pasientsikkerheten ved transfusjon av et spesifikt blodprodukt: kaldt lagret, lavtitret, leukocyttfiltrert, type-O fullblod. Konklusjonen ble følgende: På bakgrunn av best tilgjengelige evidens foreligger det ingen indikasjon for økt transfusjonsrisiko ved bruk av denne typen fullblod.
Gjennom titrering av antistoffnivå, leukocyttfiltrering og infeksjonstesting modereres risikoen for en rekke komplikasjoner. Redusert donoreksponering, forenklet transfusjonslogistikk og redusert arbeidsbelastning til involvert personell er alle faktorer som forbedrer pasientsikkerheten. Forenklet utlevering, kvalitets- og dobbeltkontroll av MTP reduserer faren for administrative feil i alle ledd (21).
Masteravhandlingen fikk etterspill. Med støtte fra aktuelle fagpersoner gjennomførte jeg i 2021–2023 en minimetodevurdering. Formålet var å undersøke om det kan være aktuelt å etablere et fullblodsprogram ved Sykehuset Telemark (22). Før nye behandlingsmetoder innføres, bør klinisk effekt, pasientsikkerhet, etiske aspekter, organisatoriske konsekvenser og kostnader kartlegges. Minimetodevurdering er et slikt forskningsbasert kartleggings- og beslutningsverktøy (23).
Vi er i mål med forskningsprosessen, og resultatene ligger til innsyn i den nasjonale databasen for minimetodevurderinger. Oppsummert i korte trekk viser resultatene at pasientsikkerheten dokumenteres som god, mens klinisk effekt i form av forbedret overlevelse og kortere liggetid på sykehus er vanskeligere å påvise. Dette har sammenheng med studienes retrospektive natur og lave pasientpopulasjon.
Hva vil det medføre å benytte fullblod?
Dobbel blodbeholdning utfordrer flere faglige, etiske, organisatoriske, logistiske og økonomiske aspekter for blodbankvirksomhetene. Tilgangen på givere med blodtypen O RhD-negativ er begrenset fra før. Omtrent 5–6 prosent av alle traumepasienter vil ha behov for massiv transfusjon, avhengig av populasjon og region (24, 25). Dermed vil sikring av døgnkontinuerlig fullblodsberedskap resultere i at ubrukte enheter må kasseres (22).
Det vil kreve innsats, vilje og ressurser å anskaffe nye blodgivere og moderere tap. På tross av ulempene tilfører stadig flere akuttmiljøer fullblod til sitt repertoar. Hvorfor begi seg ut på et økonomisk tapsprosjekt? Kan det hende at pasientens behov anses som styrende i disse fagmiljøene? I så fall står det respekt av det!
Forfatteren oppgir ingen interessekonflikter.





















1 Kommentarer
Andrew S. Louka
,Liene Stipina-Manihasa har gjenskapt en gripende klinisk situasjon og dens påvirkning på helsepersonells beslutninger. Hennes refleksjon over evidensbasert praksis var virkelig inspirerende. Hun understreker viktigheten av å stadig spørre "hvorfor", og hvordan forskning sjelden gir endelige, permanente svar. Forskningens metode er å avdekke hva som anses mest sannsynlig, gitt dagens kunnskapsnivå. Den flyktige naturen til kunnskap og praksis blir fremhevet, og viktigheten av å ta informerte og dynamiske valg understrekes.
Etablert kunnskap kan – og bør – kunne bli utfordret! De mest erfarne forskere er villig til å legge sitt livs verk bak seg og erkjenne det som feil, dersom forskning av høy kvalitet viser at det man trodde var riktig før, sannsynligvis var feil. Det handler ikke om æren av å ha rett eller ikke, det handler om livene til pasientene og deres pårørende, og søket etter de beste forklaringene av hva som observeres.
Gjennom teksten, får vi en innsikt i hvordan tidligere beslutninger kan kreve ny vurdering i lys av oppdatert kunnskap eller endret praksis. Noen må bare tørre å stille spørsmålene og følge disse opp. Dette er et glimrende eksempel på hvordan 'evidensbasert' kan tolkes i sykepleiefaget. Hvis svaret på "hvorfor" ikke tilfredsstiller, så kan man gå videre med det!
Fullblod har flere antigener enn erytrocyttkonsentrat og risikoen for transfusjonsreaksjoner vil nødvendigvis være større ved overføring av fullblod. Likevel er risiko et relativt begrep; traumapasientbehandling, laboratorieteknikker (HLA-typing m.m.) og immundempende legemidler har alle blitt utviklet de siste ~30 årene, og utviklingen på disse felt har vært betydelig. Kanskje det var riktig beslutning før, men det er inspirerende at sykepleieren stiller spørsmålet på nytt og søker svar på en systematisk, metodisk, kunnskapsbasert og således overbevisende måte.
Det er fem år siden siste utgave av Klinisk transfusjonshåndbok ble publisert (1). Jeg håper forfatteren har dialog med Norsk forening for immunologi og transfusjonsmedisin og gleder meg til fortsettelsen av denne historien.
Jeg oppfatter artikkelen som en positiv oppfordring til oss alle, å omfavne en kritisk tilnærming til eksisterende kunnskap samtidig som vi søker svarene gjennom objektive kilder og prosesser. Å tolke forskning riktig er vanskelig, men heldigvis har vi kilder som VAR Healthcare og UpToDate i den travle kliniske hverdagen.
Takk for en inspirerende fagartikkel, som har inspirert denne studenten! Å være kritisk til eksisterende kunnskap er ikke å være negativ til fortidens viten, men heller å være innovativ og søke de beste løsninger til enhver tid og redusere risikoen for skade.
Ref.
(1) Norsk forening for immunologi og transfusjonsmedisin. (2017). Praktiske aspekter ved blodtransfusjon. I T. Hervig, J. Kronborg, A. Espinosa, G. Hetland, A. Llohn, G. Kristoffersen, T. Sundic & M. Arsenovic (Red.), Klinisk transfusjonshåndbok (3. utg.). Norsk forening for immunologi og transfusjonsmedisin, Den norske legeforeningen. https://www.legeforeningen.no/foreningsledd/fagmed/norsk-forening-for-i…