Søvndybden målt i anestesiforløpet ved elektive keisersnitt etter innledning med propofol eller tiopental
Sammendrag
Bakgrunn: Keisersnitt i generell anestesi er det kirurgiske inngrepet som har høyest forekomst av utilsiktet våkenhet (awareness). Utilsiktet våkenhet under anestesi kan forårsake traumatiske komplikasjoner som angst, mareritt, søvnvansker og posttraumatisk stresslidelse.
Hensikt: Hensikten med denne systematiske oversikten var å oppsummere søvndybdemålinger gjennom hele anestesiforløpet fra randomiserte kontrollerte studier der vi sammenliknet anestesiinnledning med propofol og tiopental til elektive keisersnitt.
Metode: Studien er en systematisk oversikt med metaanalyse. Systematiske søk ble utført i databasene The Cochrane Database of Systematic Reviews (CDSR), Embase (OVID), Cinahl (EBSCO), PubMed, Google Scholar og Epistemonikos. Utfallsmålet var BIS-verdi (bispektral indeks) ved målepunktene induksjon, intubasjon, hudsnitt, uterusincisjon, forløsning, uterussutur og hudsutur.
Resultat: Totalt fire randomiserte kontrollerte studier ble inkludert i denne systematiske oversikten. Metaanalysen viser signifikant lavere BIS-verdi i favør av propofolgruppen (forskjell i gjennomsnitt –9,27; 95 prosent konfidensintervall –11,32; –7,2). For pasienter innledet med propofol er gjennomsnittlig BIS-verdi under 60, og deltakerne var i lav risiko for awareness sammenliknet med tiopentalgruppen i alle studiene. Undergruppene «induksjon», «intubasjon», «hudsnitt», «uterusincisjon», «forløsning» og «uterussutur» viser signifikante resultater i favør av lavere BIS ved innledning med propofol sammenliknet med tiopental. Beregningen av heterogenitet i metaanalysen viser høy grad av statistisk heterogenitet mellom studiene, med p-verdi < 0,00001 og I² på 78 prosent.
Konklusjon: Denne studien viser at pasienter som ble innledet med propofol ved elektive keisersnitt, har lavere risiko for å oppleve utilsiktet våkenhet under generell anestesi. Videre belyser den nødvendigheten av at anestesisykepleieren måler søvndybden og er bevisst på risikofaktorene hos den gravide som kan gi økt risiko for awareness.
Referer til artikkelen
Øvsthus J, Ramstad L, Hovland G, Hegland P. Søvndybden målt i anestesiforløpet ved elektive keisersnitt etter innledning med propofol eller tiopental. Sykepleien Forskning. 2022;17(90482):e-90482. DOI: 10.4220/Sykepleienf.2022.90482
Introduksjon
Keisersnitt i generell anestesi er forbundet med økt risiko for utilsiktet våkenhet, kalt awareness, peroperativt (1, 2, 8).
Regional anestesi er den foretrukne anestesimetoden ved keisersnitt, men under visse omstendigheter kan generell anestesi være alternativet også ved elektive inngrep. Ved koagulasjonsforstyrrelser, noen nevrologiske tilstander, mors preferanse, ryggdeformiteter og i tilfeller der regionalanestesien ikke er vellykket, er generell anestesi et alternativ (1, 2, 8).
Awareness ved generell anestesi er en fryktet komplikasjon som kan innebære at pasienten opplever å være våken uten å kunne bevege seg. Samtidig kan pasienten føle smerter og/eller høre hva som skjer i omgivelsene uten å få uttrykt det (1, 5). En viktig årsak til awareness er underdosering av sovemedisin i kombinasjon med muskelavslappende medikamenter (2, 4).
Utfordringen med anestesi ved keisersnitt er at morens behov for smertelindring og søvndybde må ivaretas, samtidig som medikamentene som administreres, påvirker barnet via placenta (1).
Inhalasjonsmedikamentene som skal sikre søvn til moren, kan gi uterusatoni, mens benzodiazepiner og opioider som skal forhindre smerter og ubehag hos moren, kan gi respirasjonsdepresjon hos barnet. Ved å underdosere disse medikamentene øker faren for awareness hos moren (1, 3).
I studiene til Brown og medarbeidere (2) og Odor og medarbeidere (3) fant de at pasienter som opplevde awareness, senere kunne få angst, mareritt, søvnvansker, stress og posttraumatisk stresslidelse (3, 4).
Risikofaktorer for awareness ved keisersnitt er vist å være lav alder, angst samt lav og høy kroppsmasseindeks (1, 3, 4). Andre risikofaktorer er akuttkirurgi umiddelbart etter anestesiinnledning, keisersnitt utført på natten, peroperativ blødning og uerfarent anestesipersonell. Den gravides fysiologiske endringer som økt hjerteminuttvolum, som igjen øker redistribusjonen av intravenøse anestesimidler og bremser etableringen av tilstrekkelig partialtrykk av anestesigass, er også en utløsende faktor (1).
Det økte hjerteminuttvolumet reduserer virkningsvarigheten av en bolusdose med induksjonsmedikament. Samtidig bidrar den endrede fysiologien til at moren trenger lengre tid til å oppnå effekt av anestesigassen (1).
I 2019 var 8670 keisersnitt registrert i Norge. Av disse fikk 959 (11,1 prosent) utført keisersnitt i generell anestesi (5). Awareness i generell anestesi ved keisersnitt tilsvarer 1 av 670 sammenliknet med 1 av 19 000 for andre kirurgiske inngrep (6).
De vanligste anestesimedikamentene som brukes ved keisersnitt for å indusere generell anestesi, er tiopental og propofol. Keisersnitt i generell anestesi har siden 1959 vært innledet med tiopental og suksametonium som standard (1, 7).
Propofol entret markedet på 1980-tallet, men flere forhold gjorde at det ikke ble tatt i bruk til keisersnitt. Tiopental var godkjent for bruk til gravide, i motsetning til propofol, og det ble videre hevdet at tiopental hadde kortere anslagstid og kunne brukes ved rapid sequence induction (RSI), rask sekvensinduksjon.
Sammenliknet med propofol ga tiopental mindre hemodynamisk påvirkning hos moren og i placenta. På bakgrunn av disse funnene forble tiopental et førstevalg fremfor propofol (7).
Studien til Tumukunde og medarbeidere (8) sammenliknet innledning med tiopental og propofol til hastekeisersnitt. De undersøkte det nyfødte barnets tilstand etter fødselen (apgarskår) og tiden fra moren fikk anestesiinnledning til hun var våken.
Tumukunde og medarbeidere konkluderte med at det ikke fantes noen signifikant forskjell i apgarskår etter fødsel mellom tiopental- og propofolgruppen (8). For mors utfall fant de at det var signifikant kortere oppvåkningstid i propofolgruppen. Park og medarbeidere (9) fant i sin studie ingen signifikant forskjell i hemodynamikk hos kvinner innledet med henholdsvis propofol eller tiopental.
Tidligere ble en enkelt dose tiopental anbefalt som det foretrukne induksjonsmiddelet for generell anestesi ved keisersnitt, men de siste årene har det skjedd en endring der propofol brukes sammen med suksametonium til innledning ved keisersnitt (3).
Sammenliknet med propofol gir tiopental fire ganger økt risiko for awareness (3), og mange lærebøker, retningslinjer og studier anbefaler også nå bruk av propofol. Induksjonsmidler som tiopental, etomidat og propofol har ikke vist noen teratogen – fosterskadelig – effekt. Ei heller har de påvirket hjerneutviklingen hos dyrefostre. Likevel er ikke bruken fastslått som sikker i Felleskatalogen (3).
Imidlertid er det høyst sannsynlig at propofol brukes off-label fordi midlet ikke er lisensiert i mange land bortsett fra USA. De fleste legemidler som brukes i obstetrisk anestesi, er kun tillatt dersom de terapeutiske fordelene overstiger risikoen (3).
Bispektral indeks (BIS) er basert på elektroencefalografi (EEG) og viser elektriske impulser fra hjernen. Verdien gjenspeiler pasientens bevissthetsnivå. Verdi på 0 representerer fravær av hjerneaktivitet, og 100 viser våken tilstand (10).
For å vurdere hvor dypt anestesert en pasient er under narkose har BIS vist seg å være et trygt måleverktøy (10). BIS-verdier mellom 40 og 60 representerer tilstrekkelig søvndybde og er anbefalt for å redusere risikoen for awareness under anestesi (10).
Hensikten med studien
Hensikten med denne systematiske oversikten var å undersøke om det er forskjell i BIS-verdien gjennom anestesiforløpet etter innledning med propofol kontra tiopental ved elektive keistersnitt. Følgende forskningsspørsmål belyses:
«Hvordan påvirker propofol sammenliknet med tiopental BIS-verdier i anestesiforløpet målt ved elektive keisersnitt i generell anestesi?»
Metode
For å kunne formulere et eksplisitt og fokusert forskningsspørsmål systematiserte og strukturerte vi søkestrategien etter PICO (tabell 1), som også ble brukt for å utvikle forskningsspørsmålet.
I PICO er de kliniske spørsmålene formulert for å identifisere fire komponenter: populasjon, intervensjon, sammenlikning og resultat (11). Søkeord ble strukturert etter PICO, og Mesh.uia.no ble brukt for å finne tekstord og emneord til søkestrategien.
Inklusjons- og eksklusjonskriterier er presentert i tabell 2.
Artikkelsøk og søkeord
Vi utførste systematiske søk siste kvartal i 2020. Et oppdateringssøk ble utført i april 2021, der ingen nye artikler ble inkludert. Vi konsulterte en universitetsbibliotekar for å få veiledning i søkestrategi og relevante databaser.
For å få flest mulig treff avgrenset vi ikke for publikasjonsår eller andre filtre i databasene. Vi kontaktet en ekspert på fagfeltet som hadde forslag til oppslagsverk og støttelitteratur.
Vi benyttet SveMed+ og MeSH for å identifisere emne- og tekstord. Systematiske søk ble utført i databasene The Cochrane Database of Systematic Reviews, Embase (OVID), Cinahl (EBSCO), PubMed, Google Scholar og Epistemonikos.
Referanselistene til inkluderte studier ble gjennomgått for å fange opp artikler som ikke ble identifisert gjennom søket, men vi indentifiserte kun duplikater her. Siden resultatet av de systematiske søkene hadde relativt få treff, gikk vi grundig gjennom dem manuelt fremfor å bruke EndNote. Alle relevante treff i Google Scholar, som var den siste databasen vi søkte i, var duplikater fra andre treff.
Vi identifiserte seks artikler på språk vi ikke behersker, som iransk, persisk og koreansk. I et forsøk på å få disse i engelsk versjon sendte vi e-post til førsteforfatterne av alle artiklene, men vi fikk ingen svar.
Seleksjon og kritisk vurdering
Første- og andreforfatteren (JØ, LMR) gikk uavhengig av hverandre gjennom titler, sammendrag og fulltekstartikler for inklusjon på bakgrunn av inklusjons- og eksklusjonskriteriene. Vurderingene av funnene ble deretter sammenliknet før vi utførte pilottest på de 40 første studiene for å kvalitetssikre en felles forståelse for kriteriene. Pilottesten gjorde det klart at vi var enig om inklusjons- og eksklusjonskriteriene.
To artikler ble kritisk vurdert for få en felles forståelse av hvordan man tolker og vurderer spørsmålene i Helsebibliotekets sjekkliste for randomiserte kontrollerte studier (12). Deretter ble de inkluderte artiklene kritisk vurdert av to personer uavhengig av hverandre.
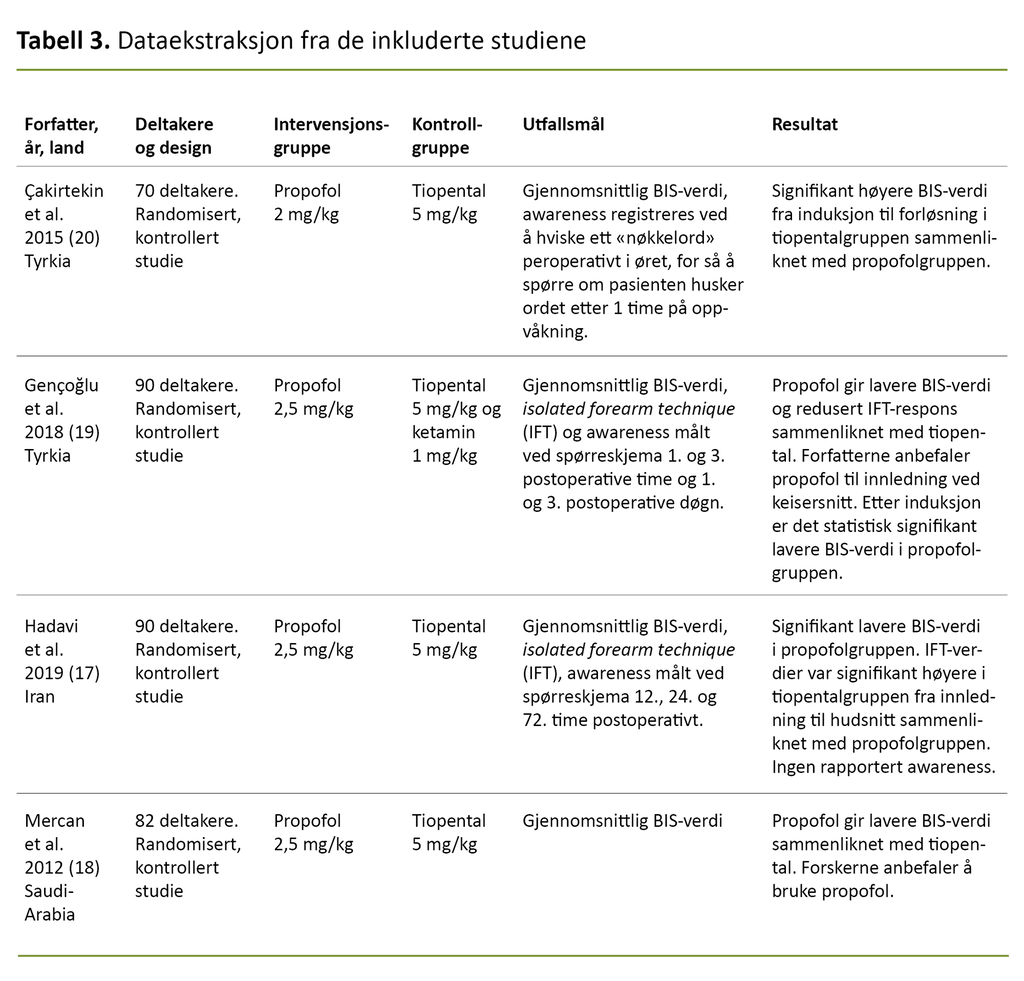
I dataekstraksjonen ble følgende data beskrevet og systematisert (se tabell 3 for detaljer): forfatter, land, år, antall deltakere, studiedesign, intervensjon, kontroll, utfall og hvordan utfallet ble målt, samt resultat.
Analyse og sammenstilling av data
For å sammenstille og analysere resultatet fra de inkluderte studiene utførte vi en metaanalyse, da de inkluderte studiene ble vurdert til å ha lav klinisk heterogenitet (13) i forhold til populasjonskarakteristika, intervensjon og inngrep. Metaanalysen ble utført i dataprogrammet Review Manager (14).
Siden enkeltundersøkelser som følge av tilfeldigheter kan påvise divergerende resultater, gir metaanalyser et sikrere grunnlag for å påvise årsakseffekter (15). Det ble ekstrahert gjennomsnittlig (mean) BIS-verdi for måletidspunktene induksjon, intubasjon, hudincisjon, uterusincisjon, forløsning, uterussutur og hudsutur. Måletidspunktene for BIS under keisersnittet ble definert i planleggingen av den systematiske oversikten, etter identifikasjon av relevant studie i pilotsøket.
Gjennomsnittlig BIS-verdi er en kontinuerlig variabel, og det ble derfor kalkulert gjennomsnittsdifferanse (MD, mean difference) med 95 prosent konfidensintervall (KI) og p-verdi (signifikansnivå ˂ 0,05) for å måle effekten i intervensjonsgruppen (propofol) versus kontrollgruppen (tiopental) for hver undergruppe samt samlet effekt for hele anestesiforløpet. Vi valgte en tilfeldig effektmodell for metaanalysen (inverse-variance, random-effects model) (16). Funnene er presentert som forest plot – balansediagram – i figur 2.
Resultater
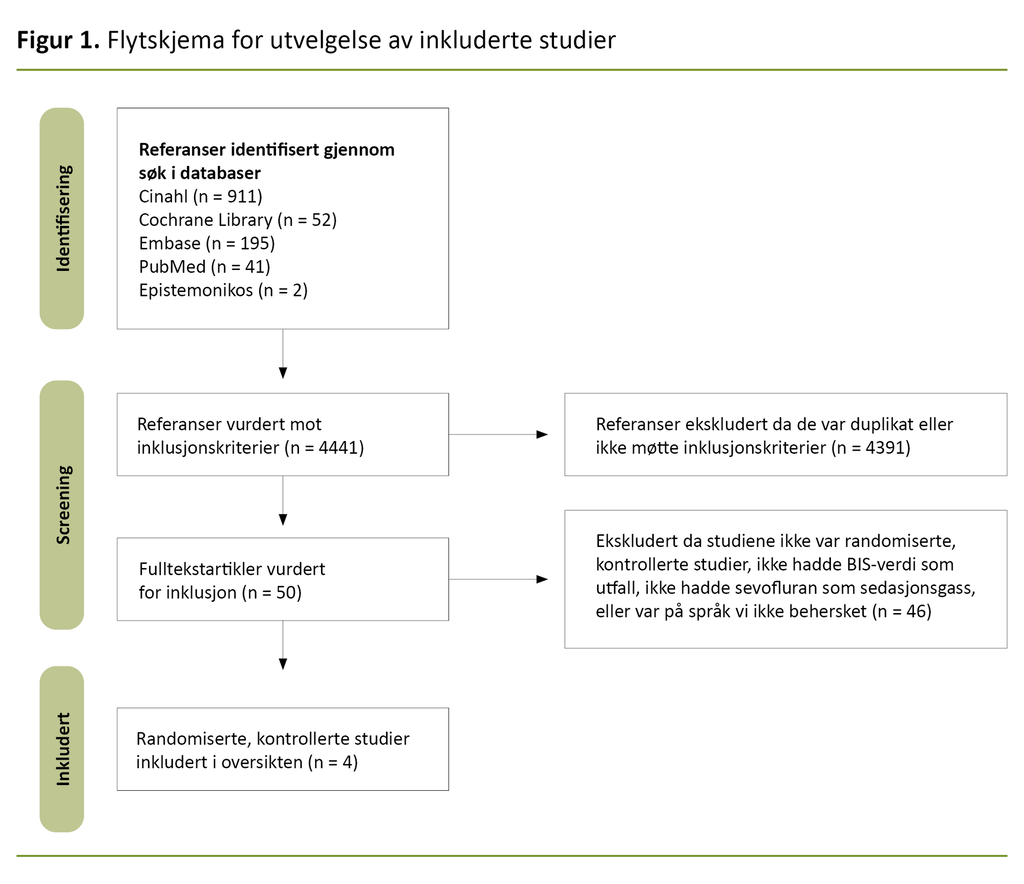
Vi identifiserte 4441 referanser gjennom systematisk litteratursøk. Av disse ble 4391 ekskludert fordi tittelen og sammendraget ikke møtte inklusjonskriteriene, var duplikater fra treff i andre databaser, var på et språk vi ikke behersker, ikke var en RCT eller manglet sammendrag eller fulltekst. Duplikater ble fjernet manuelt.
Etter dette ble 50 artikler lest i fulltekst og vurdert i henhold til inklusjons- og eksklusjonskriteriene. Totalt oppfylte fire RCT-er kriteriene for metaanalyse. Til sammen 302 pasienter var inkludert i studiene i metaanalysen.
De inkluderte studiene er utført i Tyrkia, Iran, Saudi-Arabia og Korea fra 2012 til 2020, og alle studiene hadde fått godkjenning av en forskningsetisk komité. Alle de inkluderte studiene i metaanalysen sammenliknet propofol og tiopental til innledning av keisersnitt i generell anestesi.
Det var ingen signifikant forskjell i antallet deltakere i hver gruppe, alder på deltakerne, kroppsmasseindeks, gestasjonsalder på fosteret eller studienes inklusjons- og eksklusjonskriterier.
Alle deltakerne var i alderen 18–44 år og vurdert som friske uten funksjonelle begrensninger. Deltakerne fikk utført elektivt keisersnitt, og alle deltok frivillig i forskningen. I alle studiene ble deltakerne tilfeldig fordelt i grupper, enten ved hjelp av en tabell eller et dataprogram.
Kritisk vurdering
To av artiklene har høyere validitet (17, 18) fordi de har en grundig beskrivelse av metode og randomisering sammenliknet med artikkelen til Gençoğlu og medarbeidere (19) og Çakırtekin og medarbeidere (20).
Deltakerne i alle de fire studiene blir beskrevet som likt overvåket, og alle studiene bruker BIS for å måle søvndybden. I studiene til Gençoğlu og medarbeidere (19) og Çakırtekin og medarbeidere (20) er det ikke beskrevet hvordan randomiseringen var utført, bare at deltakerne er randomisert, mens det i studien til Hadavi og medarbeidere (17) og Mercan og medarbeidere (18) er beskrevet en dobbelt-blind-teknikk av både deltakere og anestesipersonell.
Det kan være større risiko for systematisk skjevhet, eller bias, i de artiklene der det ikke er beskrevet i detalj hvordan deltakerne ble randomisert. Man kan derfor ha mindre tiltro til disse to artiklene (19, 20). Alle de fire studiene (17–20) er godt beskrevet, og metoden er tilnærmet lik, som gjør den velegnet for en metaanalyse.
Effekt av propofol versus tiopental på gjennomsnittlig BIS-verdi
Samlet effektmål på metaanalysen viste signifikant lavere BIS hos pasientene som fikk innledning med propofol versus tiopental (MD –9,27; 95 prosent KI –11,32; –7,2), noe som indikerer en betydelig redusert fare for at pasienten kan oppleve awareness.
Hvis man ser på effekt i de ulike undergruppene, varierer funnene mer, og seks av undergruppene viser effekt i favør av lavere BIS hos pasienter som innledes med propofol, mens undergruppen «hudsutur» ikke viser noen signifikant forskjell mellom gruppene. I det følgende presenterer vi funn for de ulike undergruppene.
Undergruppen «induksjon» viser lavere BIS i favør av intervensjonsgruppen propofol (MD –5,47; 95 prosent KI –8,54; –2,40). Dersom man ser på gjennomsnittlig BIS og standardavvik i studiene som er inkludert i undergruppen, er BIS under 60 både i intervensjons- og kontrollgruppen i begge studiene.
BIS-verdi i undergruppen «intubasjon» viser også signifikant forskjell mellom propofolgruppen og tiopentalgruppen, men ikke like stor signifikans som ved induksjon (MD –10,11;95 prosent KI –16,73; –3,49). I en av de inkluderte studiene hadde pasientene som ble innledet med tiopental, gjennomsnittlig BIS over 60 og er derfor i risiko for awareness.
For undergruppene «hudsnitt» og «uterusincisjon» viser analysene stor forskjell på intervensjons- og kontrollgruppen med henholdsvis MD –10,57 (95 prosent KI –13,07; –8,07) for «hudsnitt» og MD –12,9 (95 prosent KI –15,62; –10,8) for «uterusincisjon».
Den gjennomsnittlige BIS-verdien er igjen over 60 hos pasienter som ble innledet med tiopental i flere av studiene vi inkluderte i analysene. Når barnet forløses, viser det seg å være stor signifikant forskjell på gruppene. Gjennomsnittsdifferansen her er –15,04 (95 prosent KI), og det er nettopp på denne sammenlikningen at vi ser størst signifikant forskjell på gruppene. Igjen er den gjennomsnittlige BIS-verdien over 60 i kontrollgruppen i tre av de inkluderte studiene.
Etter forløsning av barnet er det mindre signifikant forskjell på gruppene i undergruppen «uterussutur» (MD –5,16; 95 prosent KI –8,34; –1,97), fortsatt i favør av pasientene som er innledet med propofol. Noen av pasientene som ble innledet med tiopental, har en gjennomsnittlig BIS over 60.
Avslutningsvis i operasjonen i undergruppen «hudsutur» viser analysene ingen signifikant forskjell på de to gruppene (MD –2,28; 95 prosent KI –8,11; 3,54). Her er det sannsynlig å tenke seg at sevoflurankonsentrasjonen er lik i begge grupper, og at verken propofol eller tipoental er gjeldende komponenter ved dette tidspunktet, derav ingen signifikant forskjell.
Det er verdt å merke seg fra metaanalysen at BIS-verdien for noen av pasientene vil være over 60 også i intervensjonsgruppen, selv om gjennomsnittlig BIS-verdi er under 60.Beregningen av heterogenitet i metaanalysen viser høy grad av statistisk heterogenitet mellom studiene, med en p-verdi < 0,00001 og I² på 78 prosent, slik som vist i figur 2.
Funnene i metaanalysen viser signifikant forskjell mellom gruppene i målepunktene induksjon, hudsnitt, uterusincisjon og forløsning i disse utfallene, og vi har høy tillit til estimatet. Resultatene i flere av våre undergrupper går i favør av intervensjonsgruppen (propofol) og har effektestimat som ikke krysser nulleffektslinjen (16). For en av undergruppene, «hudsutur», er resultatet ikke signifikant.
Diskusjon
Resultatet av metaanalysen i denne systematiske oversikten tyder på at byttet fra tiopental til propofol ved innledning til elektive keisersnitt kan være med på å forebygge awareness. Pasienter som blir innledet med propofol, hadde en klart lavere BIS-verdi sammenliknet med dem som ble innledet med tiopental.
Funnene fra denne systematiske oversikten viser at pasientene som ble anestesert med tiopental, hadde BIS-verdier der de sto i fare for å oppleve awareness. De inkluderte studiene har undersøkt elektive pasienter, og her har man derfor redusert risikofaktorene som nattarbeid, hastegrad og liten tid til forberedelse.
Tiopental ga økt risiko for awareness sammenliknet med propofol
Resultatet fra undergruppeanalysene viste at det var signifikant høyere BIS-verdi fra induksjon til forløsning i kontrollgruppen tiopental, noe som samsvarer med pasientkasuistikker som rapporterer om awareness i dette tidsrommet (3).
Resultatet støttes av Odor og medarbeidere (3), som fant at tiopental ga fire ganger økt risiko for awareness sammenliknet med propofol. De mener at det kan være et farmakologisk grunnlag for disse observasjonene og argumenterer for at man bør ha en spesifikk begrunnelse for å bruke tiopental som induksjonsmiddel fremfor å betrakte det som et standardvalg (3).
Selv om awareness er en fryktet komplikasjon ved keisersnitt, er det flere andre faktorer som påvirker både mor og barn. Hemodynamisk stabilitet er viktig for å sikre tilstrekkelig oksygenering av fosteret.
Funnene fra vår systematiske oversikt tyder på at propofol er å foretrekke til innledning av elektive keisersnitt da risikoen for utilsiktet våkenhet reduseres. Imidlertid er det ikke gitt at propofol er førstevalget ved akutte keisersnitt (1, 2). Ved akutte keisersnitt der moren er hemodynamisk ustabil, kan propofol påvirke morens hemodynamikk i en slik grad at det ikke lenger er gunstig å bruke propofol som eneste medikament (8).
I flere studier er det kartlagt disponerende faktorer, situasjoner og mulige årsaker til awareness uten at det er kommet konkrete forslag til endringer for å forebygge tilstanden (1, 3, 4).
Lite erfaring med bruk av tiopental øker faren for komplikasjoner
I tillegg til lavere BIS er det andre faktorer som gjør at det kan være anbefalt å bytte fra tiopental til propofol. Ifølge Chaggar og Campbell (1) er mindre erfarne anestesiologer lite kjent med bruken av tiopental, noe som har ført til overdosering og underdosering ved bruk av dette virkestoffet. Det har videre medført tilfeller der den gravide blir hemodynamisk ustabil eller opplever utilsiktet våkenhet.
Det er også beskrevet at det er blitt tatt feil av sprøyter fordi tiopental likner på antibiotika, og at tiopental er tidkrevende å blande ut i saltvann (1). Til sammenlikning trenger ikke propofol å blandes ut på forhånd og er dermed tidsbesparende og billigere enn tiopental (1, 7).
Midazolam i kombinasjon med propofol reduserer faren for awareness ytterligere
I studiene som er inkludert i metaanalysen, fikk pasientene administrert opioider etter forløsning. Opioider gir ingen retrograd amnesi og er ikke angstdempende på samme måte som midazolam.
I studiene til Hadavi og medarbeidere (17) og Ok og medarbeidere (21) fikk pasientene administrert midazolam etter forløsning, noe som senket BIS-verdiene ytterligere. BIS-verdier under 60 er vist å redusere risikoen for intraoperativ bevissthet i populasjoner med høy risiko for awareness (18).
I en stor retrospektiv studie fikk alle pasientene administrert midazolam etter forløsning, og ingen av pasientene opplevde awareness (9). Funn fra vår oversikt viser at BIS-verdien ikke var under den anbefalte grensen i kontrollgruppen tiopental i tre av de inkluderte studiene, og at risikoen for awareness var høyest ved forløsning (18–20).
BIS-monitorering bør være standard ved keisersnitt
I en ekspertuttalelse anbefaler Chaggar og Campbell at søvndybde monitoreres som standard for keisersnitt i generell anestesi (1). Det kan tyde på at anestesipersonellet må ha mer oppmerksomhet på søvndybden, og at BIS-monitorering burde være standard ved keisersnitt (4, 18–20).
Anestesipersonell har som oppgave å vurdere bevissthetsgrad og anestesidybde regelmessig under operasjoner, for eksempel ved å observere pupillstørrelsen, ciliereaksjon ved å stryke på pasientens øyevipp samt blodtrykk og puls. I tilfeller med høy risiko for utilsiktet våkenhet er det anbefalt å måle søvndybden med BIS-monitorering (22). Basert på funnene i denne studien styrkes argumentasjonen for å måle BIS under elektive keisersnitt.
Oppdatert forskning må ligge til grunn for endringer av praksis
Skiftet fra tiopental til propofol som anestesi til pasienter som får utført elektive keisersnitt, ble gjort som resultat av forskningsfunn (1, 4, 7). Selv om evidensgrunnlaget for induksjonsmedikamentenes effekt på BIS er lite, gir denne metaanalysen støtte for en endring fra tiopental til propofol. Men for å få et sikrere grunnlag for skiftet er det behov for flere robuste studier, fortrinnsvis randomiserte kontrollerte studier.
Det er viktig at den nye forskningen medfører endringer og oppdateringer av prosedyrer, og at anestesipersonell jobber forskningsbasert i tillegg til erfaringsbasert. Anestesifaget må basere seg på anvendt forskning, noe som vil si å bruke forskning som er rettet mot bestemte praktiske mål eller anvendelser. Det kan være lett å tenke at jo mer erfaring vi tilegner oss, jo dyktigere blir vi. Å bli god i faget sitt forutsetter imidlertid at vi i lys av våre erfaringer kan finne, vurdere og bruke forskningsbasert kunnskap i møte med den individuelle pasienten (23).
Metodiske betraktninger
Søkeresultatene ble gjennomgått grundig i flere omganger for ikke å overse aktuelle studier. Vi screenet titler og sammendrag manuelt da antallet treff var overkommelig. En universitetsbibliotekar bidro til å strukturere søk og formuleringer i PICO (24), som er en styrke for studien vår.
Dataekstraksjon fra de ulike studiene ble foretatt av to personer uavhengig av hverandre, for så å diskutere resultatene, som er en styrke ved studien (25). Vi vurderte alle de inkluderte artiklene kritisk ved hjelp av sjekklisten fra Helsebiblioteket. Her kunne vi også valgt å gjøre en risk of bias-analyse, der det lages en figur der risikoen for skjevhet er markert fra grønt til rødt for hver artikkel som ble inkludert i metaanalysen, for å gjøre det mer visuelt synlig for leseren.
Det er en styrke at vi utførte en metaanalyse, da de samlede funnene blir mer presise. Vi inkluderte bare RCT-artikler i metaanalysen (15). Svakheten ved bare å inkludere RCT er at antallet studier er begrenset (23). For å ivareta kvaliteten har vi fulgt håndboken til Cochrane Training. Det styrker analysen at vi fikk veiledning av en fagperson med kompetanse på feltet, som også har sett på beskrivelsen av resultatet.
Implikasjoner for klinisk praksis og videre forskning
I denne systematiske oversikten er det vist at propofol gir lavere BIS sammenliknet med tiopental til elektive keisersnitt. I klinisk praksis bør man derfor vurdere indikasjonen for å benytte tiopental fremfor propofol som innledning ved generell anestesi.
Denne systematiske oversikten ser på sammenhengen mellom tiopental eller propofol og awareness og etterlyser mer forskning på feltet. Det trengs også mer forskning på midazolam gitt ved keisersnitt, både hvorvidt midazolam påvirker barnet før forløsning, og hvordan det påvirker pasientens opplevelse av awareness.
En av risikofaktorene for awareness er utrent personell (3) og manglende innsikt i prosedyren for keisersnitt i generell anestesi (26). For å sikre god opplæring kan simulering og undervisning bidra til at anestesisykepleieren er bedre rustet til å handle i stressende situasjoner. Som en viktig faktor for å prøve å unngå awareness bør også BIS brukes til denne pasientgruppen for å måle søvndybden.
Konklusjon
Denne systematiske oversikten viser at pasienter som blir innledet med propofol ved elektive keisersnitt i generell anestesi, har signifikant lavere BIS-verdi enn pasienter innledet med tiopental. Pasienter som ble innledet med propofol ved elektive keisersnitt, kan dermed ha lavere risiko for å oppleve utilsiktet våkenhet under generell anestesi.
Det er imidlertid få studier inkludert i denne oversikten, og det vil være behov for flere randomiserte kontrollerte studier av god kvalitet for en sikrere konklusjon. BIS-monitorering er et evidensbasert tiltak for å monitorere søvndybden hos pasienter, og det er derfor viktig at anestesipersonellet innfører dette tiltaket hos pasienter som gjennomgår elektive keisersnitt i generell anestesi.
Takk til universitetsbibliotekar June Audsdotter Stafsnes ved Høgskulen på Vestlandet for god veiledning i forbindelse med litteratursøk. Takk også til anestesioverlege Andreas Kurt Winkler for ekspertuttalelser, veiledning i støttelitteratur og søk.
Forfatterne oppgir ingen interessekonflikter.
Referanser
1. Chaggar R, Campbell J. The future of general anaesthesia in obstetrics. BJA Education. 2017;17(3):79–83. DOI: 10.1093/bjaed/mkw046
2. Brown J, Rahman R, Wilson S, Abir G. Accidental Awareness during General Anaesthesia (AAGA) in obstetrics. Obstetric Anaesthesia – tutorial 388. 2018. Tilgjengelig fra: https://resources.wfsahq.org/wp-content/uploads/388_english-1.pdf (nedlastet 18.10.2022).
3. Odor P, Bampoe S, Lucas D, Moonesinghe S, Andrade J, Pandit J, et al. Incidence of accidental awareness during general anaesthesia in obstetrics: a multicentre, prospective cohort study. Anaesthesia. 2021;76(6):759–76. DOI: 10.1111/anae.15385
4. Czarko K, Kwiatosz-Muc M, Fijalkowska A, Kowalczyk M, Rutyna R. Intraoperative awareness – comparison of its incidence in women undergoing general anaesthesia for Caesarean section and for gynaecological procedures. Anaesthesiol Intensive Ther. 2013;45(4):200–4. DOI: 10.5603/AIT.2013.0039
5. Folkehelseinstituttet. Medisinsk fødselsregister – Statistikkbank. Oslo: Folkehelseinstituttet; 2019. Tilgjengelig fra: https://www.fhi.no/hn/helseregistre-og-registre/mfr/ (nedlastet 18.10.2022).
6. Plaat F, Lucas N, Bogod DG. 16: AAGA in obstetric anaesthesia. I: NAP 5: Accidental awareness during General Anaesthesia in the United Kingdom and Ireland – report and findings. London: The Royal College of Anaesthetists; 2014. s 133–43. Tilgjengelig fra: https://www.nationalauditprojects.org.uk/downloads/NAP5%20full%20report.pdf (nedlastet 11.10.2022).
7. Desai N, Carvalho B. General anaesthesia for caesarean section: is the end in sight for thiopental? British Journal of Hospital Medicine. 2017;78(6):358. DOI: 10.12968/hmed.2017.78.6.358
8. Tumukunde J, Lomangisi DD, Davidson O, Kintu A, Joseph E, Kwizera A. Effects of propofol versus thiopental on Apgar scores in newborns and peri-operative outcomes of women undergoing emergency cesarean section: a randomized clinical trial. BMC Anesthesiology. 2015;15(1):1–6. DOI: 10.1186/s12871-015-0044-6
9. Park H-S, Kim Y-S, Kim S-H, Jeon A-R, Kim S-E, Choi W-J. Comparison of electroencephalogram between propofol-and thiopental-induced anesthesia for awareness risk in pregnant women. Scientific Reports. 2020;10(1):1–10. DOI: 10.1038/s41598-020-62999-5
10. Mathur S, Patel J, Goldstein S, Jain A. Bispectral Index. Treasure Island, Florida: StatPearls Publishing; 2020.
11. Polit DF, Beck CT. Nursing research: generating and assessing evidence for nursing practice. 11. utg. Philadelphia, Pennsylvania: Lippincott Williams & Wilkins; 2020.
12. Helsebiblioteket. 4.1 Sjekklister. Randomisert kontrollert studie. Kunnskapsbasertpraksis.no. Tilgjengelig fra: https://www.helsebiblioteket.no/kunnskapsbasert-praksis/kritisk-vurdering/sjekklister (nedlastet 02.06.2020).
13. McKenzie J, Brennan S, Ryan R, Thomson H, Johnston R. 9. Summarizing study characteristics and preparing for synthesis. I: Cochrane Handbook for Systematic Reviews of Interventions. Versjon 6.3. The Cochrane Collaboration; 2022. Tilgjengelig fra: www.training.cochrane.org/handbook (nedlastet 06.08.2020).
14. The Nordic Cochrane Centre. Review Manager (RevMan). Versjon 5.4.1. The Cochrane Collaboration; 2020. Tilgjengelig fra: http://community.cochrane.org/tools/review-production-tools/revman-5 (nedlastet 09.08.2020).
15. Christoffersen L, Johannessen A, Tufte PA, Utne I. Forskningsmetode for sykepleierutdanningene. Oslo: Abstrakt forlag; 2015.
16. Deeks J, Higgins J, Altman D. 10. Analysing data and undertaking meta-analyses. I: Cochrane Handbook for Systematic Reviews of Interventions. Versjon 6.3. The Cochrane Collaboration; 2022. Tilgjengelig fra: www.training.cochrane.org/handbook (nedlastet 09.09.2020).
17. Hadavi M-R, Beihaghi M, Zand F, Sabetian G, Azemati S, Asadpour E. A comparison between thiopental sodium and propofol for induction of anesthesia in elective cesarean section using bispectral index and isolated forearm technique: a randomized, double-blind study. Asian Journal of Anesthesiology. 2019;57(3):93–100. DOI: 10.6859/aja.201909_57(3).0004
18. Mercan A, El-Kerdawy H, Khalill M, Al-Subaie H, Bakhamees HS. A prospective, randomized comparison of the effects of thiopental and propofol on bispectral index during caesarean section till delivery of newborn. MEJ Anesth. 2012;21:699–704.
19. Gençoğlu NN, Küçükosman G, Aydın BG, Okyay DR, Pişkin Ö, Sezer Ü, et al. Effects of preoperative anxiety and general anesthetic administration on intraoperative awareness in patients undergoing cesarean section. Medical Bulletin of Haseki. 2019;57(2). DOI: 10.4274/haseki.galenos.2018.4480
20. Çakırtekin V, Yıldırım A, Bakan N, Çelebi N, Bozkurt Ö. Comparison of the effects of thiopental sodium and propofol on haemodynamics, awareness and newborns during caesarean section under general anaesthesia. Turkish Journal of Anaesthesiology and Reanimation. 2015;43(2):106. DOI: 10.5152/TJAR.2014.75547
21. Ok SJ, Kim WY, Lee YS, Kim KG, Shin HW, Chang MS, et al. The effects of midazolam on the bispectral index after fetal expulsion in caesarean section under general anaesthesia with sevoflurane. J Int Med Res. 2009;37(1):154–62. DOI: 10.1177/147323000903700118
22. Anestesisykepleierne NSF. Grunnlagsdokumentet for anestesisykepleiere. IFNA – International Federation of Nurse Anesthetists; 2016. Tilgjengelig fra: https://www.nsf.no/sites/default/files/inline-images/zQCAUnQvcUEpG7XzVJXOgvrSk28s29K0m2gG4EZxhW7s5zspvF.pdf (nedlastet 22.10.2022).
23. Nortvedt MW, Jamtvedt G, Nordheim LV, Reinar LM, Graverholt B. Jobb kunnskapsbasert! En arbeidsbok. Oslo: Akribe; 2012.
24. Område for helsetjenester i Folkehelseinstituttet. Slik oppsummerer vi forskning. Håndbok for Folkehelseinstituttet. 4. utg. Oslo: Område for helsetjenester i Folkehelseinstituttet; 2018.
25. Deeks JJ, Higgins JP, Altman DG. 10. Analysing data and undertaking meta-analysis. I: Cochrane Handbook for Systematic Reviews of Interventions. Versjon 6.3. The Cochrane Collaboration; 2022. Tilgjengelig fra: https://training.cochrane.org/handbook/archive/v6.1/chapter-10 (nedlastet 24.10.2022).
26. Norsk anestesiologisk forening, Den Norske legeforening, Anestesisykepleiernes landsgruppe av NSF. Norsk standard for anestesi. 2016. Tilgjengelig fra: https://www.nsf.no/sites/default/files/inline-images/f99njXla94iCUrYGJrm8qOM6nRwJscUypCJQM9lEb1KJd752LN.pdf (nedlastet 24.10.2022).
Les også Keiseren befalte keisersnitt
Følgende tekst ble fjernet da kun Jeanette Øvsthus er førsteforfatter: Jeanette Øvsthus og Linn Merethe Ramstad har bidratt like mye og deler førsteforfatterskapet.














0 Kommentarer