Antibiotikaresistente tarmbakterier på pasientenes hender – en sonderende oversikt
Sammendrag
Bakgrunn: Fordi pasienter kan bidra til kryssmitte, anbefaler Folkehelseinstituttet håndhygiene som et smitteforebyggende tiltak i helseinstitusjoner. Helsetjenesteassosierte infeksjoner er fryktede komplikasjoner ved sykehusopphold, og en infeksjon med en antibiotikaresistent bakterie vil øke faren ytterligere for komplikasjoner og død. Antibiotikaresistente bakterier etablerer seg ofte i den normale bakteriefloraen i tarmen, som medfører bærerskap av antibiotikaresistente tarmbakterier.
Hensikt: Å kartlegge og oppsummere forskningslitteratur om pasientenes håndhygiene på sykehus, særlig hvilken betydning den kan ha for spredning av antibiotikaresistente tarmbakterier.
Metode: Vi benyttet sonderende oversikt basert på Arksey og O’Malleys rammeverk som metode. Vi har hentet litteratur fra MEDLINE, Embase, Global Health, AMED og Cinahl.
Resultat: Vi identifiserte 2184 artikler og inkluderte åtte artikler fra USA, Sveits, Sverige og Hongkong som samsvarte med inklusjonskriteriene. Alle de åtte artiklene omhandler forekomst, tiltak eller begge deler. Vi undersøkte forekomsten av antibiotikaresistente tarmbakterier på pasientenes hender og overflater og identifiserte tiltak rettet mot pasientens håndhygiene. Forekomsten av enkelte antibiotikaresistente tarmbakterier på pasientenes hender samsvarte med funn på overflater. Vi identifiserte følgende tiltak rettet mot pasientens håndhygiene: opplæring, direkte observasjoner av håndhygiene, påminnelser, tilrettelegging for håndhygiene og tilgjengelig hånddesinfeksjon. Disse tiltakene, i kombinasjon med andre smitteforebyggende tiltak, førte til færre antibiotikaresistente tarmbakterier på pasientenes hender og sjeldnere utbrudd av antibiotikaresistente tarmbakterier.
Konklusjon: Mer oppmerksomhet på pasientenes etterlevelse av håndhygiene på sykehus kan ha betydning for infeksjonsforekomsten og håndteringen av utbrudd av antibiotikaresistente tarmbakterier. Pasientenes håndhygiene nevnes i litteraturen som en mulig faktor som kan ha relevans for spredning til andre pasienters nære omgivelser eller miljøet i sykehusavdelinger. Der anbefales det at håndhygienefasiliteter er lett tilgjengelig for pasientene, og at de får informasjon og veiledning om håndhygiene.
Referer til artikkelen
Bjerkås M, Riise H. Antibiotikaresistente tarmbakterier på pasientenes hender – en sonderende oversikt. Sykepleien Forskning. 2025;20(102648):e-102648. DOI: 10.4220/Sykepleienf.2025.102648
Introduksjon
Til tross for at helsepersonells håndhygiene er anerkjent som det viktigste smitteforebyggende tiltaket på helseinstitusjoner verden over (1), har pasientenes håndhygiene fått lite oppmerksomhet. Folkehelseinstituttet anbefaler at pasienter skal praktisere håndhygiene som et smitteforebyggende tiltak på alle helseinstitusjoner (2). Det er i tråd med tilrådninger fra Centers for Disease Control and Prevention (CDC) i USA (3).
Likevel har ikke Verdens helseorganisasjon (WHO) (1) og European Centre for Disease Prevention and Control (ECDC) egne anbefalinger for pasientenes håndhygiene (4). Pasienter er bærere av patogener på hendene (5) og berører helsepersonell, overflater på gjenstander og områder med høy berøringsfrekvens mens de er innlagt på sykehus, noe som kan føre til indirekte overføring av patogener.
Direkte overføring mellom pasienter kan også forekomme (6). Tre prosent av innlagte pasienter på norske sykehus får en helsetjenesteassosiert infeksjon (HAI) (7). I Europa forventes det årlig 3,5 millioner tilfeller av HAI (8). Derfor er det behov for å undersøke nærmere om pasientenes håndhygiene bør vies større oppmerksomhet som et smitteforebyggende tiltak.
HAI er en infeksjon som pasienter pådrar seg mens de er innlagt på sykehus eller en annen helseinstitusjon (8). HAI er en fryktet komplikasjon som påfører pasientene ekstra lidelse, og som har stor ressursmessig betydning for sykehusdriften. Selv en liten reduksjon i antallet infeksjoner vil føre til besparelser i helsevesenet, mindre lidelse for de som blir rammet av infeksjonene, og færre dødsfall (7).
Antibiotikaresistens er et økende problem, både nasjonalt og globalt. Antibiotikaresistente bakterier vil ofte etablere seg i en persons normale bakterieflora, eksempelvis blant tarmbakteriene. Vedkommende blir da bærer av antibiotikaresistente bakterier i tarmen. Disse personene som er bærere av antibiotikaresistente tarmbakterier, blir ikke nødvendigvis syke selv, men kan bidra til å spre antibiotikaresistens (9), blant annet via hendene etter toalettbesøk.
Antibiotikaresistente tarmbakterier er bakterier som finnes naturlig i tarmen, men som har utviklet resistens mot en eller flere typer antibiotika. Gramnegative stavbakterier kan utvikle flere ulike resistensmekanismer. En gruppe som har stor klinisk betydning, er extended spectrum beta-lactamase (ESBL), som kan forekomme hos mange bakterietyper (9).
Forekomsten av resistente enterobakterier og enterokokker har økt de siste årene. Spesielt Escherichia coli, Klebsiella pneumoniae og vankomycinresistente enterokokker (VRE) skaper store utfordringer for pasientbehandling og smittevern i helsetjenesten (10, 11). VRE kan overleve i én time på hendene og opptil fire måneder i omgivelsene (12). I Europa utgjør økningen av antibiotikaresistente tarmbakterier en signifikant trussel for helsevesenet (13).
Når antibiotikaresistente bakterier gir sykdom, er disse infeksjonene vanskeligere å behandle enn andre infeksjoner. Det vil være større fare for komplikasjoner, langvarig sykdomsforløp og økt dødelighet for pasienter med en slik infeksjon (9).
Til tross for veletablerte retningslinjer for helsepersonells håndhygiene ser pasientens håndhygiene ut til å være et underutforsket område og et hull i kunnskapsgrunnlaget for forebyggende tiltak mot infeksjoner med antibiotikaresistente bakterier på sykehus.
Hensikten med studien
Hensikten med denne studien var å kartlegge og oppsummere forskningslitteratur om pasientenes håndhygiene på sykehus, særlig hvilken rolle den kan ha i å spre antibiotikaresistente tarmbakterier.
For å belyse dette har vi valgt følgende forskningsspørsmål: «Hva sier forskningslitteraturen om pasienters håndhygiene på sykehus og dens mulige betydning for spredning av antibiotikaresistente tarmbakterier?»
Metode
Vi valgte sonderende oversikt basert på rammeverket til Arksey og O’Malley som vår metode for å utforske litteraturen om sammenhengen mellom pasientenes håndhygiene på sykehus og antibiotikaresistente tarmbakterier.
Rammeverket består av fem stadier: identifisering av forskningsspørsmålet, identifisering av relevante studier, studieseleksjon, kartlegging av data og oppsummering av resultatene (14). Videre baserte vi litteraturoversikten på PRISMA-sjekklisten for scoping reviews (15).
Identifisering av forskningsspørsmål og relevante studier
I det første stadiet utviklet vi forskningsspørsmålet, søkeord og søkestrategi. For å svare på forskningsspørsmålet var hovedseleksjonskriteriene forskningslitteratur som undersøkte pasientenes håndhygiene, og som i tillegg inkluderte antibiotikaresistente tarmbakterier. PCC er anbefalt som en guide for å konstruere en klar og meningsfull tittel i sonderende oversikter. PCC står for population (populasjon), concept (konsept) og context (kontekst).
Det skal være kongruens mellom tittel, forskningsspørsmål og inklusjonskriterier. I en sonderende oversikt er det ikke behov for eksplisitte utfall, intervensjoner eller fenomener, men elementer av hver av disse kan ligge implisitt i konseptet som undersøkes (16).
Populasjonen som vi undersøkte i denne sonderende oversikten, er voksne, våkne pasienter. Konseptet er pasientenes håndhygiene og antibiotikaresistente tarmbakterier. Konteksten er sengepost på sykehus. 15. november 2022 gjennomførte vi et litteratursøk i databasene MEDLINE, Embase, Global Health, AMED og Cinahl (vedlegg 1).
I litteratursøket benyttet vi følgende søkeord uten trunkeringer: patient, inpatient, hospitalized, institutionalized, hand hygiene, hand hygienic, handwash, hand-wash, hand disinfect, hand wash, hand sanitize, hand sanitise, hand antiseptic, hand contaminate, hand decontaminate, hands disinfect, hands wash, hands sanitize, hands sanitise, hands antiseptic, hands contaminate, hands decontaminate, alcohol hand sanitizer, alcohol hand sanitiser, alcohol hand rub.
Søkeordene ble kombinert med boolske operatorer og nærhetsoperatorer for å sikre relevante treff, og søkene ble tilpasset de enkelte databasene. Vi utførte søket uten tidsbegrensning og i samarbeid med en bibliotekar.
Vi gjorde et nytt identisk søk 13. september 2024, denne gangen med tidsbegrensningen 16. november 2022 til 13. september 2024. Dette søket identifiserte 144 nye treff, som alle ble ekskludert (figur 1). Vi gjennomførte søk etter grå litteratur i Google Scholar, men dette ga uhåndterbart mange treff. Vi har derfor ikke inkludert grå litteratur i vår sonderende oversikt.
Studieseleksjon
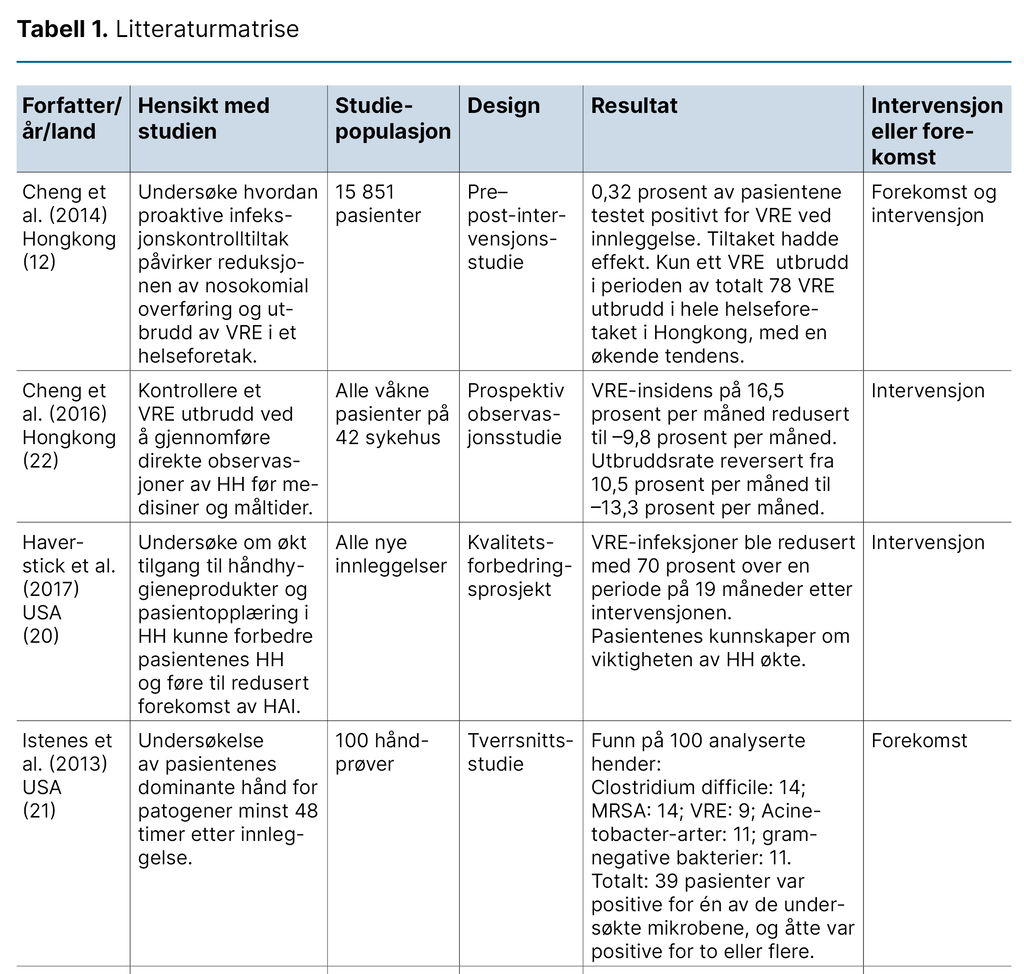
I det andre stadiet selekterte vi artikler basert på inklusjonskriteriene: a) pasientens håndhygiene, b) voksne pasienter, c) sykehus, d) sengepost, e) antibiotikaresistente tarmbakterier og f) fulltekst tilgjengelig. I hovedsøket i alle databasene identifiserte vi 1569 artikler, i sekundærsøket 588. Etter at vi fjernet 763 duplikater, gjensto 1421 studier for gjennomgang av tittel og abstrakt.
For å teste inklusjonskriteriene gjennomførte først begge forfatterne en blindet test av ti prosent av studiene (n = 128) i hovedsøket. Den viste samsvar i de inkluderte og ekskluderte artiklene. Deretter gikk vi gjennom de resterende artiklene. Av de 57 studiene som gjensto for fulltekstgjennomgang, ble 49 (86 prosent) ekskludert, og åtte inkluderte artikler gjensto.
Flytskjema over inkluderte studier er oppdatert etter sekundærsøket. Vi benyttet Covidence (17) for å sikre en blindet og objektiv utvelgelse av artikler, og hele screeningprosessen ble gjennomført av begge forfatterne.
Kartlegging av data og oppsummering av resultatene
Førsteforfatteren ekstraherte data fra de inkluderte artiklene. Resultatene er oppsummert i en litteraturmatrise (tabell 1). Vi har ikke vurdert kvaliteten på de inkluderte artiklene, da dette ikke er vanlig i sonderende oversikter (14).
Etikk
Vi har ikke benyttet informanter eller helseopplysninger. Dermed er ikke studien vurdert av Regionale komiteer for medisinsk og helsefaglig forskningsetikk (REK) eller Sikt – Kunnskapssektorens tjenesteleverandør.
Resultater
Beskrivelse av de inkluderte artiklene
Fire studier (50 prosent) ble utført i USA (18–21), to (25 prosent) i Hongkong (12, 22), en (12,5 prosent) i Sveits (23) og en (12,5 prosent) i Sverige (24). Det var stor variasjon i studiepopulasjonen i de inkluderte studiene, fra én enkelt forsøksperson til 42 inkluderte sykehus.
Også studiedesignet varierte: en observasjonsstudie, et kvalitetsforbedringsprosjekt, en kohortstudie, en tverrsnittsstudie, en pre–post-intervensjonsstudie, en kasuistikkstudie, en randomisert kontrollert studie (RCT) og en kasus–kontroll-studie.
To studier utførte en intervensjon (20, 22), og to studier kartla forekomsten av antibiotikaresistente tarmbakterier på pasientenes hender eller overflater (18, 21). Fire studier utførte både en intervensjon og kartla forekomsten (12, 19, 23, 24).
Identifiserte hovedkategorier
Vi identifiserte områder knyttet til pasientenes håndhygiene og antibiotikaresistente tarmbakterier og delte innholdet i to kategorier: 1) «Forekomst av antibiotikaresistente tarmbakterier på pasientenes hender eller overflater», og 2) «Tiltak rettet mot pasientens håndhygiene».
Forekomst av antibiotikaresistente tarmbakterier på pasientenes hender eller overflater
Fire studier undersøkte forekomsten av antibiotikaresistente tarmbakterier på sykehuspasientenes hender (18, 19, 21, 23). Alle fire fant tilstedeværelse av antibiotikaresistente tarmbakterier i tillegg til andre bakterier. To av studiene undersøkte hendene 48 timer etter innleggelse på sykehus (21, 25).
I studien til Istenes og medarbeidere (21) undersøkte de den dominante hånden til 100 pasienter. Av antibiotikaresistente tarmbakterier fant de VRE på ni pasienter (9 prosent).
I studien til Mody og medarbeidere (18), der de undersøkte hendene for antibiotikaresistente bakterier ved innleggelse og regelmessig under oppholdet, var 28 pasienter av totalt 399 (7 prosent) kolonisert med antibiotikaresistente tarmbakterier på hendene ved innleggelse. Av disse hadde 20 pasienter (5 prosent) resistente gramnegative bakterier (RGNB), og åtte (2 prosent) hadde VRE.
Ullrich og medarbeidere (23) benyttet nanopartikler i studien sin, som kan sammenliknes med VRE. De plantet nanopartikler på setemuskelen til en pasient før toalettbesøk for å illustrere hvordan VRE kan spre seg i et sykehusmiljø når kun én pasient er ukjent bærer.
Forekomsten av disse partiklene ble undersøkt på 73 forhåndsdefinerte steder i løpet av de neste åtte timene, blant annet på pasientens hender, overflater og felles kontaktpunkter på sykehusavdelingen. De utførte tre tester og fant nanopartikler på den kontaminerte pasientens hender ved alle tre testene, mens nabopasienten ikke hadde nanopartikler på hendene i noen av testene. Nabopasienten utførte håndhygiene ofte i form av håndvask og hånddesinfeksjon.
Dette funnet samsvarer med funnene i studien til Sunkesula og medarbeidere (19), der de også så en lavere forekomst av mikrober på hendene til pasientene som utførte en håndhygieneintervensjon.
Overflater eller områder med høy berøringsfrekvens fra både helsepersonell og pasienter er beskrevet i tre studier (18, 19, 23). Pasientenes omgivelser – pasientsonen – er et slikt område. Både Mody og medarbeidere (18) og Sunkesula og medarbeidere (19) ønsket å undersøke sammenhengen mellom funn av mikrober på pasientenes hender og funn av mikrober på overflater.
Mody og medarbeidere (18) oppdaget at funn av VRE og RGNB på hendene samsvarte med funn på overflatene på pasientrommene. Sunkesula og medarbeidere (19), derimot, fant ingen fluorokinolon-resistente gramnegative bakterier på overflatene på rommene til de pasientene som hadde disse bakteriene på hendene.
I studien til Ullrich og medarbeidere (23), der de undersøkte spredning både på pasientrommet og ellers i sykehusavdelingen, fant de partiklene på 80,8 prosent av overflatene de testet. Hos nabopasienten, hvor de kun fant partikler på hendene i én av seks tester (16,7 prosent), fant de likevel nanopartikler på fjernkontrollen til sengen, på hans intravenøse pumpe og på ulike gjenstander, som mobiltelefonen.
Tiltak rettet mot pasientens håndhygiene
Av tiltak rettet mot pasientenes håndhygiene er opplæring benyttet i tre studier (19, 20, 24). I studien til Ransjö og medarbeidere (24) hadde de skriftlige og muntlige påminnelser, i tillegg til opplæring i håndhygiene til pasientene. Tiltakene kom etter 20 måneder med utbrudd av ESBL – produserende Klebsiella pneumoniae. De fikk kontroll på utbruddet åtte måneder etter at tiltak for å bedre pasientenes håndhygiene ble innført.
I de to andre studiene (19, 20) delte de ut alkoholbasert hånddesinfeksjon og baserte opplæringen på den pasientsentrerte, helsepersonellstøttede modellen for å forbedre pasientens håndhygiene: «Four moments for patient hand hygiene». Modellen anbefaler håndvask i følgende situasjoner: 1) før og etter berøring av sår eller medisinsk utstyr tilkoplet kroppen, 2) før spising, 3) etter toalettbesøk, og 4) når man kommer inn eller går ut av pasientrommet (25).
I studien til Haverstick og medarbeidere (20) ble VRE redusert med 70 prosent i løpet av de 19 månedene intervensjonen pågikk. I alle de tre studiene som så på tiltak rettet mot pasientenes håndhygiene, hdde tiltakene effekt.
Sunkesula og medarbeidere (19) undersøkte om en håndhygieneintervensjon kunne påvirke forekomsten av bakterier på hendene. De hadde en intervensjonsgruppe (n = 44) og en kontrollgruppe (n = 47).
I denne studien fant de også antibiotikaresistente tarmbakterier, men bare av typen fluorokinolon-resistente gramnegative bakterier og ingen VRE. De fant fluorokinolon-resistente gramnegative bakterier på hendene til to pasienter (4,3 prosent) i kontrollgruppen og ingen (null) i intervensjonsgruppen.
Andre tiltak omfattet blant annet direkte observasjoner av håndhygiene, der helsepersonell observerte pasienten for å sikre at håndhygiene ble utført. Dette tiltaket ble benyttet i to studier fra Hongkong (12, 22) og hadde effekt i begge studiene.
Cheng og medarbeidere (12) gjennomførte i den ene studien direkte observasjoner av håndhygiene som et forebyggende tiltak, spesifikt før måltider, før medisiner og etter bruk av bekken. I tillegg ble pasientene oppfordret til å utføre håndhygiene etter toalettbesøk.
Hongkong har delt sine 42 offentlige sykehus inn i sju helseforetak. I perioden tiltakene pågikk, var det en økende tendens til utbrudd i alle de andre helseforetakene i Hongkong, med 78 VRE-utbrudd. Imidlertid var det bare ett utbrudd i helseforetaket i studien.
I den andre studien fra Hongkong av Cheng og medarbeidere (22) gjennomførte de direkte observasjoner av håndhygiene før medisiner og måltider som et tiltak i forbindelse med et VRE-utbrudd som pågikk i fire år og ti måneder. Pasientene fikk også regelmessige påminnelser om tiltaket i form av plakater.
Etter innføring av tiltak så de at utbruddsraten for VRE reverserte seg fra en økning på 10,5 prosent per måned til en reduksjon på 13,3 prosent per måned. Etterlevelsen av håndhygiene hos pasientene før inntak av måltider og medisiner var på 97,3 prosent.
Diskusjon
Oppsummerte hovedfunn
Oppsummert viser studiene at pasienter på sykehus som etterlever håndhygienetiltak, har lavere forekomst av antibiotikaresistente bakterier på hendene. I tillegg kan pasienter på sykehus som etterlever håndhygiene i definerte situasjoner, for eksempel etter toalettbesøk eller før måltider, muligens bidra til å stanse utbrudd eller spredning av antibiotikaresistente tarmbakterier til overflater.
Forekomst av antibiotikaresistente tarmbakterier på pasientenes hender eller overflater
Flere studier fant antibiotikaresistente tarmbakterier på hendene til pasientene, både ved innleggelse og under sykehusoppholdet (18, 19, 21). Enkelte mikrober, som Klebsiella pneumoniae, har god overlevelsesevne på hud, og håndhygiene blir da avgjørende for å få kontroll på en slik mikrobe (24).
I studien til Ullrich og medarbeidere (23), som benyttet en VRE-etterlikning, ble imidlertid pasientsonen kontaminert selv om pasienten hadde god håndhygiene og det bare var funn på pasientens hender i en av seks tester. Det kan muligens forklares med at VRE kun lever i én time på hendene, men kan leve i opptil fire måneder i omgivelsene (12).
Studien til Ullrich og medarbeidere (23) inkluderte kun én pasient, så det er vanskelig å dra konklusjoner. Funnene reiser likevel et interessant spørsmål rundt betydningen av pasientenes håndhygiene, da studien viser hvor raskt VRE kan spres i en sykehusavdeling selv om man bare har én pasient som er bærer av VRE. Partiklene fra denne ene pasienten førte til at 80,8 prosent forhåndsdefinerte steder i en sykehusavdeling ble kontaminert, blant annet toalettsetet, håndvasken inne på toalettet, dørhåndtaket på toalettet og pasientens hender (23).
Dersom pasienten hadde utført håndvask etter toalettbesøket slik at hendene ble rene, ville kun noen av de kontaminerte stedene fått partiklene på seg. Studien påpeker viktigheten av renhold og isolering av VRE-positive pasienter. Den viser også hvor viktig det er at alle brukere av fellesarealer, både besøkende, medpasienter og helsepersonell, samt alt helsepersonell som berører pasienten, utfører håndhygiene. Studien er også viktig for å understøtte at oppmerksomhet på helsepersonells håndhygiene er det viktigste smitteforebyggende tiltaket i helseinstitusjoner.
De siste årene har sykehusene endret praksis ved at pasientene oppfordres til å være aktive og delaktige i sin egen rekonvalesens (26). Det medfører hyppige berøringer av felles kontaktpunkter samt mye aktivitet inn og ut av pasientrom. Ifølge «Four moments for patient hand hygiene» (25) er en av anledningene for håndvask når man kommer inn eller går ut av pasientrommet.
Pasienter oppfordres også til å være delaktige ved å hente mat selv. En masteroppgave som så på håndhygiene i forbindelse med buffeter på et norsk sykehus, konkluderte med at buffeter kan medføre risiko for overføring av sykdomsfremkallende mikrober (27).
Som tidligere nevnt har mikrober ulik evne til å overleve på overflater. I studiene som har undersøkt om forekomsten av mikrober på hendene samsvarer med funn av mikrober på overflater (18, 19, 23), er det motstridende funn. Studiene er små og ulike, men de stiller interessante spørsmål om helsepersonellets rolle i kontaminering av overflatene i pasientenes omgivelser, og om type mikrobe kan være av betydning.
Pasienter infisert med bakteriene VRE og multiresistente gramnegative staver har til felles at de potensielt kan forurense sykehusmiljøet. Disse bakteriene, som er svært vanlige i helseinstitusjoner, kan i forskjellig grad overleve på ulike overflater og er vanskelige å utrydde med rengjøring eller desinfeksjon (28).
I to av studiene (18, 19) ble det påvist multiresistente gramnegative staver på hendene til pasientene. Selv om disse patogenene ble funnet hos pasientene i begge studiene, ble de ikke påvist på overflatene i begge pasientrommene. Det kan skyldes forskjeller i overflatemateriale, temperaturforhold og renholdsrutiner.
Tiltak rettet mot pasientens håndhygiene
To av studiene viste at systematisk opplæring i håndhygiene kombinert med enkel tilgang til hånddesinfeksjon hadde en betydelig innvirkning på VRE-infeksjoner og funn av fluorokinolon-resistente gramnegative bakterier på pasientenes hender (19, 20).
Økt kunnskap om håndhygiene hos pasienter, sammen med god tilgang til hånddesinfeksjon, ser ut til å være effektive tiltak for å redusere infeksjoner. Tilgang til hånddesinfeksjonsmidler fører til økt etterlevelse hos helsepersonell (29), og det er sannsynlig å tro at det samme vil gjelde for pasienter.
Begge studiene benyttet modellen «Four moments for patient hand hygiene» (25), som anbefaler håndhygiene i bestemte situasjoner. Modellen er tydelig og konkret for de involverte, som pasienter og helsepersonell, og den åpner ikke for at man selv kan avgjøre i hvilke situasjoner håndhygiene er anbefalt.
En evidensbasert systematisering av rutiner sørger for å kvalitetssikre arbeidet som utføres på sykehus. I helse- og omsorgstjenestene er det en lovfestet plikt å jobbe systematisk med kvalitetsforbedring og pasientsikkerhet (30), og her kan «Four moments for patient hand hygiene» benyttes.
Kunnskap om håndhygiene kombinert med ulike typer påminnelser snudde et utbrudd av ESBL-produserende Klebsiella pneumoniae på et sykehus i Sverige. Utbruddet hadde pågått i 20 måneder, og 247 pasienter hadde fått påvist mikroben (24).
Etter så lang tid og så mange smittede pasienter er det grunn til å tro at motivasjonen blant de ansatte var stor for å få reversert utbruddet. Mange isolerte pasienter medfører mye ekstraarbeid for de ansatte, og infeksjoner med antibiotikaresistente bakterier medfører økt risiko for pasientene.
Vi ser i dag at antallet smitteutbrudd øker, noe som igjen fører til at flere pasienter må isoleres på grunn av infeksjoner. En slik situasjon medfører store utfordringer for helsepersonellet som er involvert (31).
I Norge har sykehus plikt til å organisere og etablere rutiner som sikrer forsvarlige helsetjenester. Plikten innebærer også at virksomhetens eier og ledelse har ansvaret for å legge forholdene til rette, slik at hver enkelt helsearbeider kan utføre sine oppgaver på en forsvarlig måte (32). Gode rutiner rundt infeksjonsforebygging må forankres i ledelsen slik at de ansatte har kunnskap og ressurser til å forebygge spredning av infeksjoner på en sykehusavdeling.
To studier viste at et nyttig tiltak for å forebygge smitte og stoppe smitteutbrudd er å gjennomføre direkte observasjoner av håndhygiene (12, 22). Det er verdt å merke seg at i studien til Cheng og medarbeidere (12) ble alle pasientene screenet for VRE ved innleggelse og deretter isolert ved funn av VRE. Det påvirket sannsynligvis også spredningen av VRE på sykehuset.
Likevel oppnådde de en høy etterlevelse av håndhygiene blant pasientene ved at de gjennomførte direkte observasjoner i spesifikke situasjoner i studien sin. Vi har ingen kunnskap om hvor ofte pasienter vasker seg på hendene i Norge, men en engelsk 24-timers observasjonsstudie viser at pasienter utfører håndhygiene i 56 prosent av situasjonene (n = 164) håndhygiene er anbefalt på sykehus (33).
Pasienter har ulikt kunnskapsnivå om viktigheten av håndhygiene, men dette er heller ikke kartlagt. Direkte observasjoner av håndhygiene før måltider kan være vanskelig å følge opp på norske sykehus, blant annet på grunn av organiseringen av måltidene.
Håndhygieneintervensjoner rettet mot pasienter kan også påvirke helsepersonellets etterlevelse av håndhygiene. Andre studier viser at håndhygieneintervensjoner rettet mot pasienter førte til 30 prosent økt etterlevelse blant helsepersonell (34). De pasientrettede håndhygieneintervensjonene i de inkluderte studiene kan dermed ha påvirket helsepersonellets etterlevelse, og videre også resultatene.
Diskusjon av metode, styrker og begrensninger
Sonderende oversikt er en egnet metode når den tilgjengelige litteraturen har forskjellige forskningsdesign og kvaliteten på inkludert litteratur ikke skal vurderes. Ved å gjennomføre en sonderende oversikt har det vært mulig å utføre en litteraturstudie for å identifisere områder der det er behov for videre forskning på denne tematikken.
En styrke i studien er at en bibliotekar var involvert i hele søkeprosessen, og at litteraturgjennomgangen og inklusjonen av artikler ble utført av to uavhengige personer. De inkluderte studiene har ulike forskningsdesign, noe som kan være en styrke fordi man får belyst temaet fra forskjellige sider.
Den manuelle prosessen med screening for å identifisere artikler om pasienters håndhygiene og tarmbakterier kan ha medført at artikler har blitt oversett. Pasientenes håndhygiene er ikke et eget søkeord, og hvis man kombinerer pasienter og håndhygiene i et litteratursøk, vil man få svært mange uønskede treff som omhandler håndhygiene generelt og helsepersonells håndhygiene.
Det er også utfordrende med alle begrepene og forkortelsene i forbindelse med antibiotikaresistente tarmbakterier, eksempelvis VRE, RGNB og ESBL, som man må ha kunnskap om for å kunne identifisere relevante studier.
Ekstraksjon av data ble utført av én person, som kan ha medført at relevante data ble oversett. I tillegg inneholdt de inkluderte studiene flere typer bakterier enn tarmbakterier, noe som førte til at vi inkluderte kun deler av innholdet i studiene. Det kan ha medført en ukomplett ekstraksjon av data, og sammenhenger kan ha blitt borte.
Konklusjon
Bedre håndhygiene blant pasienter, sammen med andre smitteverntiltak, nevnes i litteraturen som en mulig viktig faktor for å redusere infeksjoner på sykehus og håndtere utbrudd av antibiotikaresistente tarmbakterier.
Der antas det at pasientenes håndhygiene kan virke inn på forekomsten av antibiotikaresistente tarmbakterier, og at god håndhygiene muligens kan redusere spredning til andre pasienters nære omgivelser og det øvrige sykehusmiljøet. Håndhygiene blant pasienter bør imidlertid betraktes som et supplement til allerede etablerte og evidensbaserte smitteforebyggende tiltak.
Videre forskning bør undersøke hvilke tiltak som er forbundet med høy etterlevelse av håndhygiene blant pasienter i spesifikke situasjoner, slik at innsatsen kan målrettes og gi ønskede resultater uten unødig ressursbruk. Det er også behov for kunnskap om varighet og skalerbarhet av håndhygienetiltak blant pasienter, på tvers av ulike sykehusavdelinger og pasientgrupper.
Forfatterne oppgir ingen interessekonflikter.
Åpen tilgang CC BY 4.0
Hva studien tilfører av ny kunnskap
Rettelse i tabell 1: Teksten "Pasientenes kunnskaper om viktigheten av HH økte." lagt til under "Resultat" i rad 3: "Haverstick et al. (2017) USA (20)" (16.02.2026)

















0 Kommentarer