Infeksjonsovervåkning på sykehjem gjennom 18 måneder under og etter covid-19-pandemien
Sammendrag
Bakgrunn: Helsetjenesteassosierte infeksjoner er en viktig årsak til lidelse og død blant beboere på sykehjem. Mange av infeksjonene behandles med antibiotika. Dette høye forbruket kan øke den antimikrobielle resistensen, som er et av de største globale folkehelseproblemene. Det viktigste tiltaket for å redusere antibiotikabruken er å redusere antallet infeksjoner. Overvåkning av infeksjoner er en viktig del av infeksjonsforebyggingen og bør igangsettes for raskt å få kontroll på infeksjonsutbrudd og hindre flere smittede. De fleste beboere på sykehjem har nedsatt immunsystem og funksjonsevne og er spesielt utsatt for alvorlig sykdom og død av infeksjoner.
Hensikt: Å overvåke infeksjoner på sykehjem over lang tid og undersøke forekomsten av ulike typer infeksjoner, hvilke typer antibiotika som brukes i sykehjem, og hvordan sosiodemografiske variabler assosiert med infeksjonsforekomst endret seg gjennom pandemien.
Metode: Helsepersonell på 22 sykehjemsavdelinger sendte inn ukentlige rapporteringsskjemaer gjennom 18 måneder, fra februar 2021 til og med august 2022. Rapportene fra hver avdeling inneholdt informasjon om antallet infeksjoner, type infeksjon, beboernes kjønn, alder, antibiotikabehandling og type antibiotika. Vi benyttet deskriptive og tidsfaste regresjonsanalyser.
Resultat: I alt ble det innrapportert 1625 infeksjoner. Av alle nye infeksjoner hadde 91,8 prosent oppstått på sykehjemmet, og hele 88,2 prosent av dem ble behandlet med antibiotika. Urinveisinfeksjoner var hyppigst rapportert, etterfulgt av luftveis- og hudinfeksjoner. Virkestoffene trimetoprim-sulfametoksazol, amoksicillin og mecillinam var de tre mest brukte antibiotikaene. Antallet sykehusinnleggelser økte i takt med antallet infeksjoner gjennom hele studieperioden.
Konklusjon: Funnene fra denne kvantitative prospektive studien dokumenterer infeksjoner og antibiotikabruk ved norske sykehjem. Flere beboere på sykehjem blir smittet med infeksjoner og trenger sykehusinnleggelse som følge av infeksjonen. Infeksjonsforebygging, som inkluderer overvåkning av infeksjoner, kan bidra til å redusere antallet infeksjoner og med det lidelse og død hos beboere på sykehjem. En reduksjon i antallet infeksjoner vil også redusere bruken av antibiotika og utviklingen av antibiotikaresistens.
Referer til artikkelen
Sandbekken I, Hermansen Å, Grov E, Utne I, Løyland B. Infeksjonsovervåkning på sykehjem gjennom 18 måneder under og etter covid-19-pandemien. Sykepleien Forskning. 2024;19(97178):e-97178. DOI: 10.4220/Sykepleienf.2024.97178
Introduksjon
Helsetjenesteassosierte infeksjoner, også kalt HAI, er infeksjoner som oppstår når en pasient er på et sykehus eller en helseinstitusjon. De er utbredte og en viktig årsak til lidelse og død blant beboere på sykehjem (1, 2). Mange av infeksjonene behandles med antibiotika, og det høye forbruket av antibiotika bidrar til antimikrobiell resistens (3). De forente nasjoner (FN) anser antimikrobiell resistens som et av de største globale folkehelseproblemene (4).
På sykehjem har sykepleiere en viktig rolle med å begrense både unødvendig forskrivning av antibiotika og spredning av antibiotikaresistens (5, 6). Det viktigste tiltaket man kan utføre for å redusere den høye bruken av antibiotika, er å redusere antallet infeksjoner (3, 7).
En viktig del av infeksjonsforebyggingen er å overvåke antallet infeksjoner (8, 9). Det kan gi oss informasjon og kunnskap om hvor ofte infeksjoner forekommer, og hvilke typer infeksjoner det er snakk om. Det er viktig å oppdage et infeksjonsutbrudd tidlig og rekke å sette inn infeksjonsforebyggende tiltak før infeksjonen sprer seg til flere personer (5, 10).
Verdens helseorganisasjon (WHO) mener at å overvåke infeksjoner må ha førsteprioritet i institusjoner (8). I Helse- og omsorgsdepartementets «Handlingsplan for et bedre smittevern med det mål å redusere helsetjenesteassosierte infeksjoner 2019–2023» er et av delmålene å bedre infeksjonsovervåkningen i sykehus og kommunale helseinstitusjoner (5).
Målene i handlingsplanen er fremdeles ikke realisert. Norge overvåker mange tilstander og har kvalitetsregistre over dem. Likevel finnes det ikke et system som overvåker infeksjoner kontinuerlig i helsetjenesteinstitusjonene (5). Folkehelseinstituttet gjennomfører en prevalensundersøkelse to ganger hvert år (NIOS-PIAH), der de etterspør hvor mange pasienter som har de fire hyppigst forekommende helsetjenesteassosierte infeksjonene på måledagen (2).
Svarprosenten har vært lav over tid, selv om det er obligatorisk for sykehjem å delta. I november 2023 deltok kun 47,5 prosent av alle sykehjem i Norge. Undersøkelsen viste at 3,5 prosent av beboerne på sykehjem hadde en helsetjenesteassosiert infeksjon. Av disse var 1,7 prosent urinveisinfeksjoner, 0,9 prosent luftveisinfeksjoner og henholdsvis 0,7 og 0,1 prosent hud- og sårinfeksjon eller infeksjon i operasjonsområdet (2).
Under covid-19-pandemien opplevde eldre høyere sykelighet og dødelighet, og beboere på sykehjem var spesielt utsatt (11, 12). De fleste beboere på sykehjem er eldre, og den naturlige aldringsprosessen kan føre til redusert immunsystem og nedsatt fysisk og kognitiv funksjonsevne (13–15).
I tillegg vil økende alder også øke risikoen for flere og kroniske sykdommer, som kan føre til skrøpelighet (13). Denne kombinasjonen gjør at beboere på sykehjem er spesielt utsatt for å få infeksjoner (14, 15), og lite kan gjøres for å unngå disse risikofaktorene. De opplever også oftere alvorligere forløp ved infeksjoner, som lengre sykehusinnleggelser, lidelse og død (2, 9, 16, 17). Norges dødsårsaksregister viser at infeksjoner er den tredje vanligste dødsårsaken i andre helseinstitusjoner enn sykehus (18). Mange av disse infeksjonene kunne vært unngått (2, 9, 16).
Denne studien er den første som kartlegger infeksjonsinsidens og bruk av antibiotika på et utvalg av sykehjem over tid i Norge. Formålet med studien var å overvåke infeksjoner i sykehjem over en lengre periode for å undersøke forekomsten av ulike typer infeksjoner, hvilke typer antibiotika som oftest brukes i sykehjem, og hvordan sosiodemografiske variabler assosiert med infeksjonsforekomst endret seg gjennom pandemien.
Metode
Design
Denne studien er en kvantitativ prospektiv studie med ukentlige rapporteringsskjemaer for å overvåke forekomsten av infeksjoner på sykehjem over en periode på 18 måneder. Datainnsamlingen startet i februar 2021 og varte til og med august 2022.
Utvalg og rekruttering
I desember 2020 fikk 17 sykehjem som skulle veilede studenter i klinisk praksis fra Oslomet – storbyuniversitetet, informasjon om studien via e-post, med en forespørsel om å delta. Vi kontaktet sykehjemmene igjen på telefon i januar 2021 for å gi mer informasjon om studien samt ny forespørsel om å delta.
Rapporteringsskjema og datainnsamling
Sykehjemsavdelingene valgte ut ansatte som skulle sende inn ukentlige rapporteringer om infeksjoner og antibiotikabruk via den elektroniske løsningen Nettskjema. Svarene ble sendt direkte til Tjenester for Sensitive Data (TSD) (19).
Rapporteringsskjemaet inneholdt spørsmål om hvor mange beboere som hadde eller hadde hatt en infeksjon den siste uken, deres kjønn og alder (≤ 84 eller ≥ 85), når og hvor (på eller utenfor sykehjemmet) infeksjonen startet, type infeksjon, om beboeren hadde mer enn én infeksjon, samt om det ble brukt antibiotika mot infeksjonen. Hvis ja stilte vi spørsmål om typen antibiotika, startdato og antatt lengde på behandlingen.
Rapporteringsskjemaet ble utviklet til prosjektet med bakgrunn i den kliniske erfaringen til forfatterne og de ansatte ved en sykehjemsavdeling. Skjemaet ble pilottestet av avdelingslederen og sykepleierne ved en avdeling før studien startet. I tråd med deres tilbakemeldinger endret vi formuleringen av noen spørsmål og la til flere forhåndsutfylte typer antibiotika for å gjøre skjemaet enklere og raskere å fylle ut.
Avdelingene fikk en påminnelse via e-post uken etter hvis de ikke hadde sendt inn en rapport. Vi ringte opp avdelingene hvis det manglet flere ukesrapporteringer.
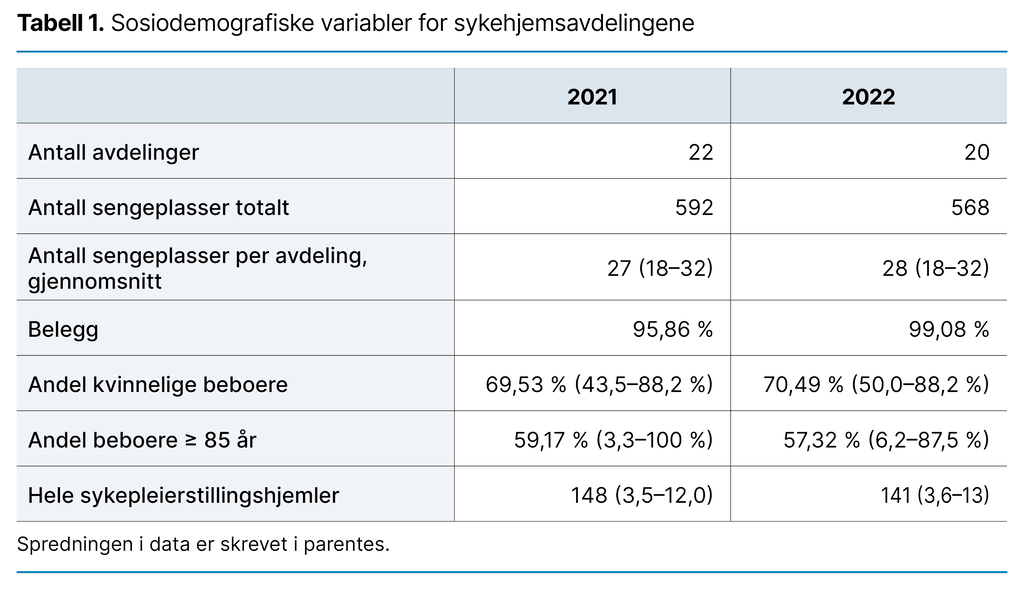
I tillegg til rapporteringsskjemaet fikk avdelingene tilsendt et spørreskjema om sosiodemografiske variabler to ganger i løpet av studieperioden – sommeren 2021 og 2022. Dette skjemaet inneholdt spørsmål om typen avdeling (lang- eller korttid), det totale antallet senger og beboere, beboernes alder (≤ 84 eller ≥ 85) og kjønn, antallet stillingshjemler og antallet sykepleierstillingshjemler.
Dataanalyse
Statistiske analyser ble utført i Stata versjon 16. Vi gjennomgikk rapportene i sin helhet. Uker med manglende rapporter ble lagt til med manglende verdi (missing). Helsepersonell kunne velge kategorien «annet», både under type infeksjon og antibiotikum, og skrive inn fritekstsvar.
Under «infeksjoner» består kategorien «annet» av 50 ulike typer infeksjoner, og under «antibiotikum» består kategorien av 26 forskjellige typer. Kategorien «ukjent fokus» under «infeksjoner» innebærer at helsepersonell har oppdaget en infeksjon, men er usikker på hvilken type infeksjon det er.
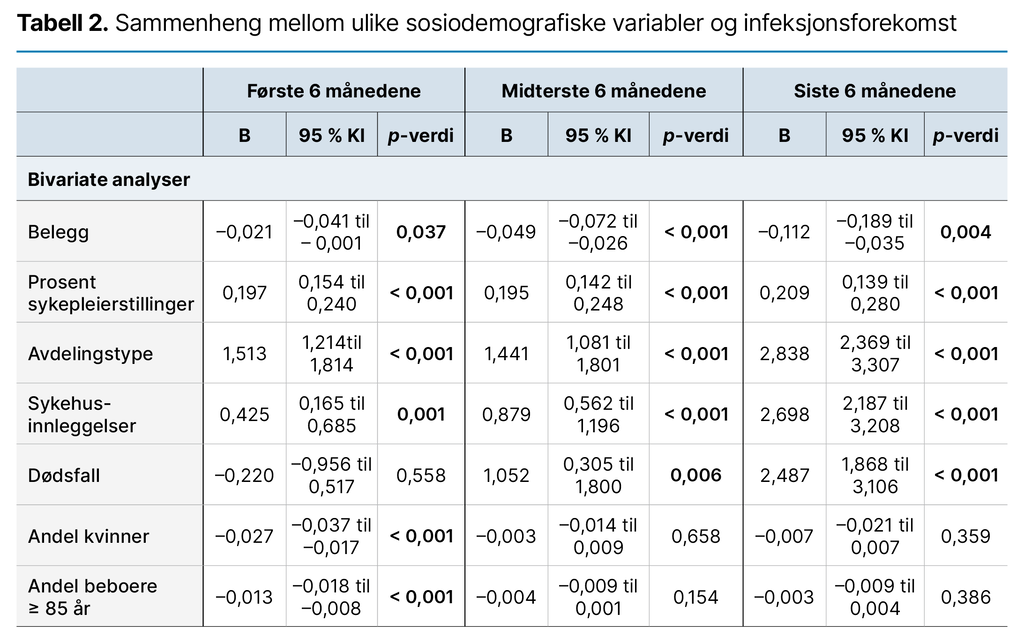
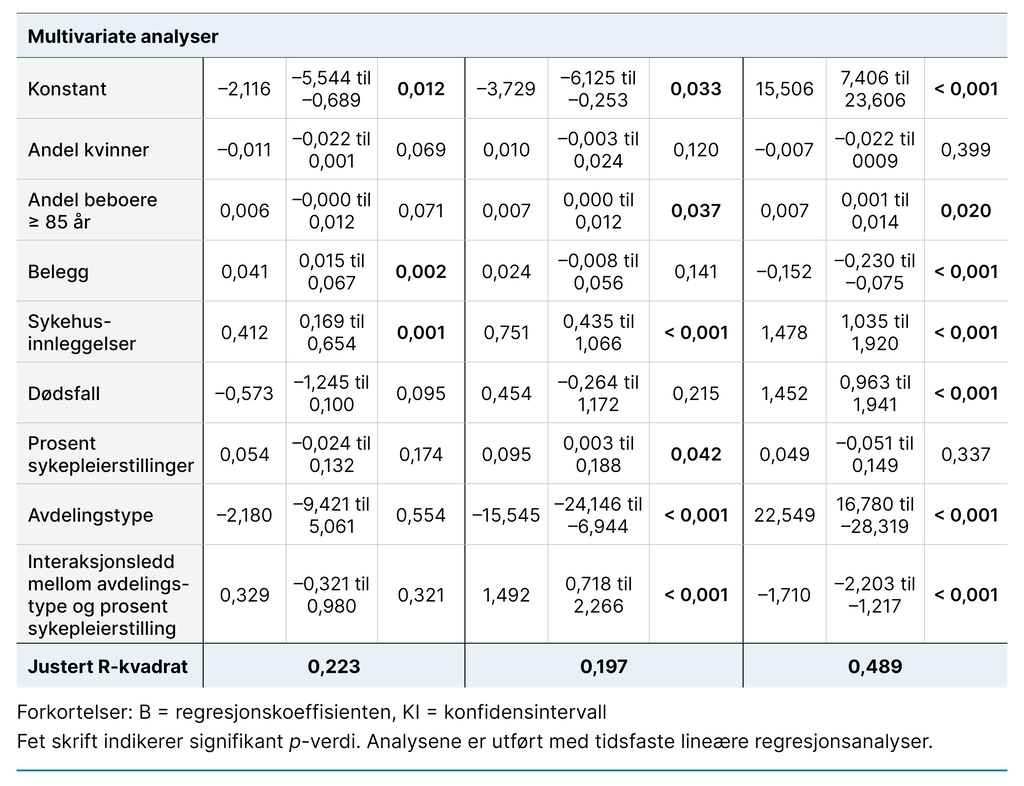
Deskriptive analyser ble utført, inkludert krysstabell. Vi gjennomførte tidsfaste lineære regresjonsanalyser for å undersøke hvilke sosiodemografiske variabler som kunne assosieres med infeksjonsforekomst, og hvordan disse variablene endret seg i løpet av studiens varighet. Vi delte de 18 månedene i tre, med seks måneder i hver tidsperiode.
Alle signifikante variabler i bivariate analyser på et av de tre tidspunktene ble inkludert trinnvis i en multippel regresjonsanalyse for hver tidsperiode. Antallet infeksjoner som ble rapportert hver uke, ble brukt som avhengig variabel. Et interaksjonsledd mellom «type avdeling» og «prosent sykepleierstilling» ble inkludert i regresjonsanalysen.
Ved signifikant resultat betyr det at effekten av antallet sykepleiere (prosent sykepleierstilling) på antallet infeksjoner er forskjellig avhengig av avdelingstype. Variabelen «belegg» er en prosent på hvor mange av avdelingens sengeplasser som er opptatt, og variabelen «prosent sykepleierstilling» viser til antallet hele stillingshjemler. P-verdier på < 0,05 ble ansett som statistisk signifikant.
Etiske overveielser
Denne studien er en del av et større prosjekt. Prosjektet er gjennomgått og vurdert av Regional komité for medisinsk og helsefaglig forskningsetikk (REK), referansenummer 196911 og 226694/REK Sør-Øst. Sikt – Kunnskapssektorens tjenesteleverandør vurderte at prosjektet fulgte personvernreglementet, referansenummer 118936.
Beboerne på sykehjemmene og deres pårørende fikk informasjonsskriv om studien. Der fikk de informasjon om studien, at de kunne reservere seg mot at data om den aktuelle beboeren skulle samles inn til studien, og at hver enkelt kunne trekke seg. Før studien kunne starte, mottok avdelingslederen eller kvalitetssjefen ved hvert sykehjem et informasjonsskriv og måtte signere en samarbeidsavtale for hver deltakende avdeling.
Resultater
Det var 22 sykehjemsavdelinger fra 9 ulike sykehjem som ønsket å delta i studien. Avdelingene besto av 3 korttidsavdelinger og 19 langtidsavdelinger i 2021, og 2 korttidsavdelinger og 17 langtidsavdelinger i 2022. Våren 2022 ble 2 avdelinger lagt ned, som resulterte i 2 færre avdelinger i 2022.
Sommeren 2021 var 15 av avdelingene organisert ved at hver avdeling besto av flere små grupper med eget kjøkken. Alle beboerne hadde eget toalett, mens 7 avdelinger hadde storavdeling med felles toalett for flere eller alle beboerne. Sommeren 2022 hadde fremdeles 15 avdelinger små grupper og eget toalett til beboerne, mens antallet som hadde storavdeling med felles toalett var redusert til 5. Tabell 1 viser sosiodemografiske variabler.
Gjennom de 83 ukene med rapporteringer fikk vi inn 1391 ukentlige rapporter. Hver avdeling leverte i gjennomsnitt 63 rapporter, men det var stor spredning fra 31 til 81.
Infeksjoner på sykehjem
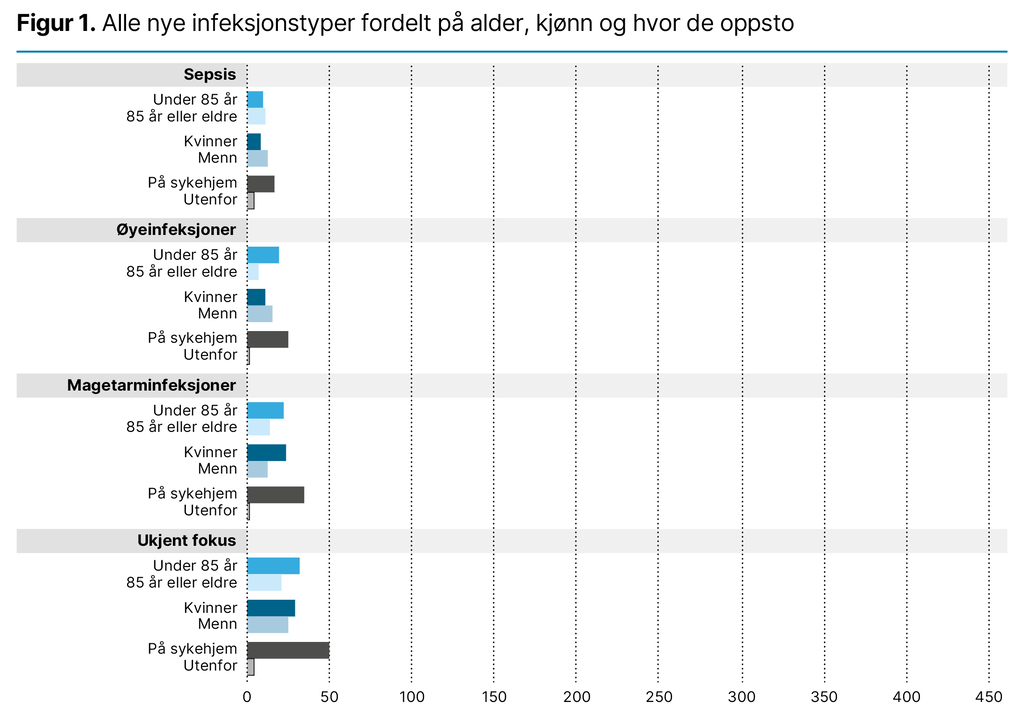
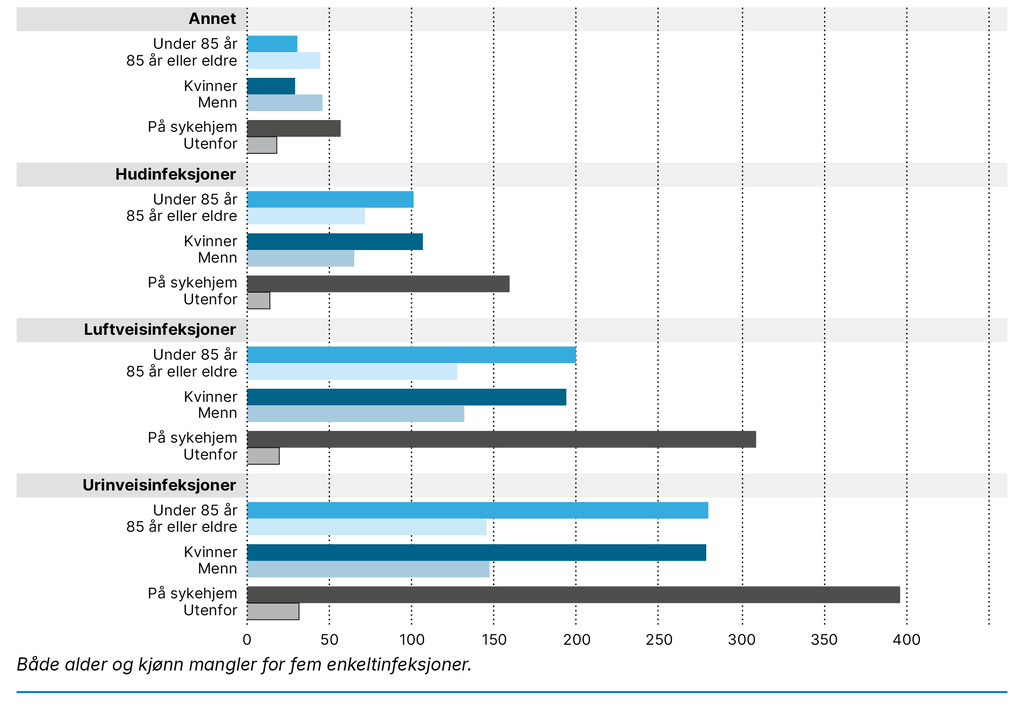
I løpet av de 18 månedene med datainnsamling ble det registrert 1625 infeksjoner. Av alle nye infeksjoner hadde 91,8 prosent oppstått på sykehjemmene, og kun 8,2 prosent av dem var infeksjoner beboerne hadde da de kom til sykehjemmene. På korttidsavdelingene var denne andelen høyere: 19,7–27,8. Det ble rapportert at 30,0 prosent av infeksjonene hadde en varighet på over én uke. Det var flest urinveisinfeksjoner etterfulgt av luftveis- og hudinfeksjoner (figur 1).
Antibiotikabruk på sykehjem
De forskjellige infeksjonstypene ble som regel behandlet med antibiotika, og hele 88,2 prosent av alle de nye infeksjonene ble behandlet med antibiotika. Urinveisinfeksjoner ble behandlet med antibiotika i 98,2 prosent av tilfellene, hudinfeksjoner i 92,5 prosent og luftveisinfeksjoner i 75,9 prosent av tilfellene. Unntaket var mage–tarm-infeksjoner, der 61,8 prosent av infeksjonene ikke ble behandlet med antibiotika.
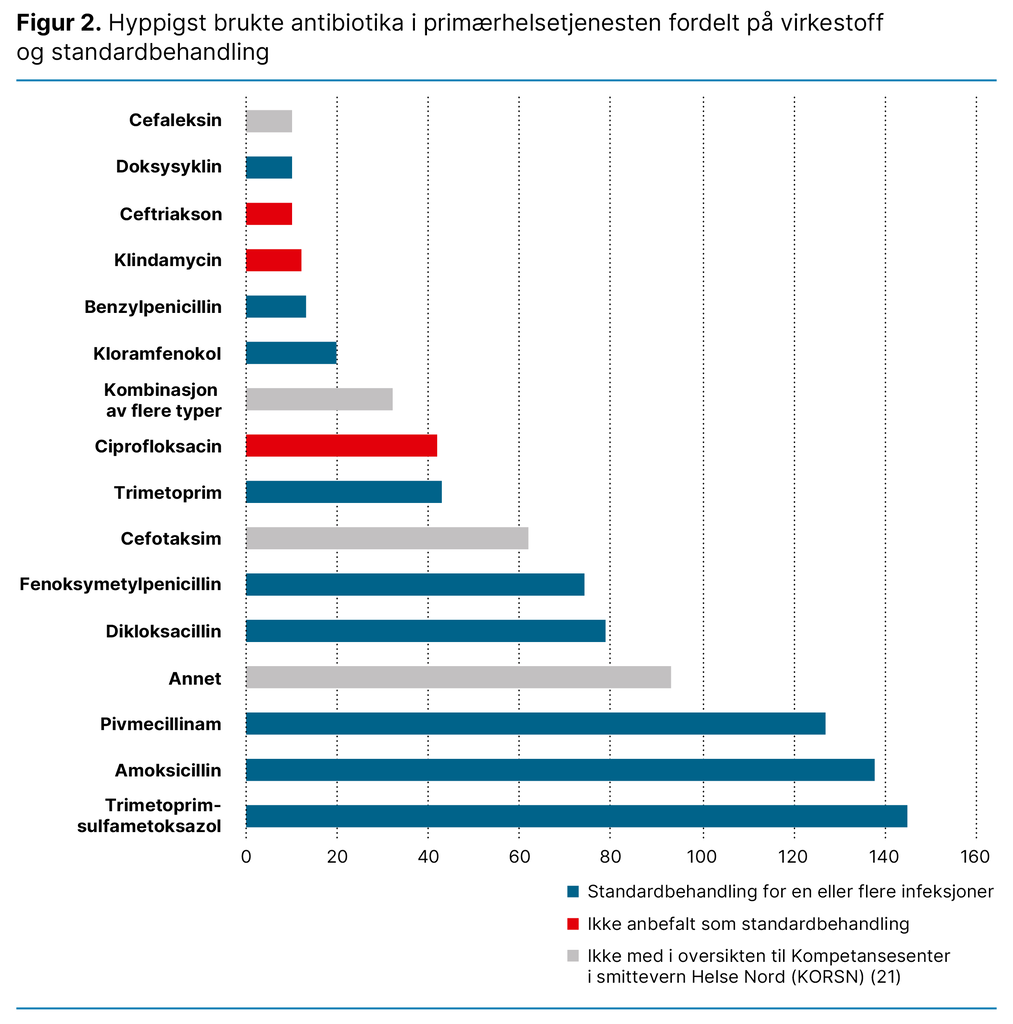
Virkestoffene trimetoprim-sulfametoksazol, amoksicillin og mecillinam var de tre mest brukte. Figur 2 viser fordelingen av de ulike virkestoffene. Den er fargelagt for å synliggjøre hvilken antibiotika som inngår i standardbehandling i primærhelsetjenesten (20, 21).
Kategorien «annet» består av 20 forskjellige antibiotika som alle ble brukt mindre enn 10 ganger hver. «Kombinasjon av flere typer» kan både være to forskjellige legemidler eller et kombinasjonspreparat.
Luftveisinfeksjoner ble hyppigst behandlet med amoksicillin (34,2 prosent) etterfulgt av fenoksymetylpenicillin (19,9 prosent). Urinveisinfeksjoner ble behandlet med pivmecillinam i 32,5 prosent og trimetoprim-sulfametoksazol i 27,1 prosent av tilfellene. Hudinfeksjonene ble hyppigst behandlet med dikloksacillin (47,3 prosent), etterfulgt av kategorien «annet» (26,0 prosent).
Mage–tarm-infeksjoner (76,9 prosent), sepsis (33,3 prosent), infeksjoner med ukjent fokus (26,3 prosent) og infeksjonssamlebetegnelsen «annet» (40,0 prosent) ble oftest behandlet med antibiotika fra antibiotikasamlekategorien «annet». Denne kategorien besto av forskjellige typer antibiotika som alle ble rapportert mindre enn ti ganger hver.
Sosiodemografiske variabler assosiert med infeksjonsforekomst gjennom studien
Resultatene fra regresjonsanalysene viser forskjellige signifikante resultater gjennom de tre ulike seksmånedersperiodene. Resultatene viser at høye infeksjonstall opptrer samtidig som antallet sykehusinnleggelser er høyt, som er den eneste variabelen som er signifikant gjennom hele perioden (tabell 2).
Den trinnvise inkluderingen av variabler viste at interaksjonsleddet mellom «type avdeling» og «prosent sykepleierstilling» var den variabelen som var viktigst for å forklare endringen i antallet infeksjoner. Gjennom de tre tidsperiodene forklarte variabelen henholdsvis 11,99, 12,64 og 18,10 prosent (justert R-kvadrat) av endringen i infeksjonsforekomst. I den siste perioden var variabelen sykehusinnleggelser viktigst for å forklare infeksjonsforekomsten, med 20,83 prosent.
Diskusjon
Denne studien er den første i landet som overvåket infeksjoner og antibiotikabruk på et utvalg sykehjem over en periode på 18 måneder. Den beskriver forekomsten av de ulike typene infeksjoner og antibiotikaene som er hyppigst brukt på sykehjem.
De fleste infeksjonene oppstår på sykehjemmet
Hele 88 prosent av alle identifiserte infeksjoner i denne studien oppsto på sykehjem, og mange av disse kunne sannsynligvis vært unngått med bedre infeksjonsforebygging (9, 16). I 2022 viste dødsregisteret i Norge at av 24 809 dødsfall på andre helseinstitusjoner enn sykehus, var 3161 på grunn av infeksiøse sykdommer, covid-19, influensa og lungebetennelse. Det gjør infeksjoner til den tredje vanligste dødsårsaken i andre helseinstitusjoner enn sykehus, kun slått av svulster og hjerte–kar-sykdommer (18).
I motsetning til svulster og hjerte–kar-sykdommer er de fleste infeksjonene smittsomme og kan forebygges på sykehjem. Beboere på sykehjem er generelt sårbare, som kan forklares med høy alder-multimorbiditet (13–15) og redusert iboende kapasitet. Det medfører at sykehjemsbeboere er særlig utsatt for infeksjoner og alvorlige følger av en infeksjon (2, 9, 16, 17).
I tillegg opplever eldre atypiske symptomer og problemer med å kommunisere relevante symptomer til helsepersonellet (15, 22). Samlet sett kan disse faktorene føre til forsinket oppstart av nødvendige behandlingstiltak samt alvorligere forløp som sykehusinnleggelser, sepsis og død (15). Håndhygiene er det viktigste og mest kostnadseffektive tiltaket vi har mot spredning av infeksjoner (8).
Tidligere funn fra dette forskningsprosjektet har vist at håndhygieneetterlevelsen på sykehjem kun er 58 prosent (23), men multimodale intervensjoner kan bedre den (24). Samtidig er smitte av infeksjoner sammensatt, og god håndhygiene vil ikke hindre all smitte. Kontinuerlig overvåkning av infeksjoner vil gjøre det mulig med en rask respons med relevante smitteverntiltak, slik at flere beboere unngår å bli smittet.
Antibiotikabruk på sykehjem
De hyppigst brukte antibiotikaene som vi fant i studien vår, samsvarte i stor grad med legemidlene som var hyppigst brukt av personer over 75 år i 2020, ifølge reseptregisteret (25). Bredspektret antibiotika er standardbehandling ved flere infeksjoner (20) og kan forklare hvorfor vi fant at flere bredspektrede typer antibiotika var blant de mest brukte.
I studien vår var det ikke mulig å undersøke om antibiotika ble forskrevet med riktig indikasjon. Feil og unødvendig bruk av antibiotika kan føre til økt resistensutvikling. Spesielt vil bruk av bredspektret antibiotika føre til større resistensutvikling enn bruk av smalspektret antibiotika (26).
Noe som skiller vår studie fra reseptregisteret, er at verken metenamin eller nitrofurantoin er hyppig brukt. Ingen av disse antibiotikaene har mer enn ti registreringer i løpet av de atten månedene og befinner seg derfor i kategorien «annen» i denne studien. Reseptregisteret viser at metenamin og nitrofurantoin var de sjette og åttende mest brukte antibiotikaene i 2020 blant personer over 75 år (25).
Metenamin, med det mest kjente produktnavnet Hiprex, er kategorisert som et antibakterielt middel med en antiseptisk effekt. Det brukes til langtidsforebygging av kroniske residiverende urinveisinfeksjoner (27). Resultatene fra en undersøkelse i 2016 viste at Norge var det landet i EU/EØS som brukte mest metenamin (28).
Derfor er det overraskende at det er rapportert om veldig lite bruk av dette legemiddelet i studien vår. En mulig grunn kan være at sykehjemsleger har blitt mer restriktive med å forskrive legemiddelet. Resultater fra forskning der den forebyggende effekten av metenamin ble undersøkt, har vært uklare (29). Derfor har det ikke vært en tydelig anbefaling om å bruke metenamin (30).
Likevel har det den siste tiden kommet sterke bevis på at legemiddelet kan ha en forebyggende effekt, men det er kun hvis urinen har riktig pH-verdi, og stoffet det omdannes til, formaldehyd, har en viss konsentrasjon og blir værende i blæren en viss tid. Derfor er det for eksempel ikke forventet at pasienter med permanent urinkateter har effekt av metenamin (29).
Sykehjemsleger kan ha tatt hensyn til dette, som kan ha ført til redusert bruk. Det er likevel usikkert om en reduksjon i bruk av metenamin har ført til en økning av et annet antibiotikum. Metenamin er et antiseptisk middel, og det er foreløpig ikke sett at bruk av middelet fører til økt antimikrobiell resistens (30). Derfor bør man vurdere om bruk av metenamin er mer fordelaktig enn gjentatte urinveisinfeksjoner som behandles med antibiotika som øker den antimikrobielle resistensen (31).
En annen årsak til lav rapportering av metenamin kan være at sykehjemmene som deltok i denne studien, ikke tenkte på at de burde inkludere forebyggende antibiotikabehandling. Selv om rapportene har vist noen få tilfeller av forebyggende behandling, har det vært under ti tilfeller per antibiotikum, og det har derfor ikke blitt synliggjort i denne studien.
Antallet infeksjoner varierte gjennom datainnsamlingsperioden
Mange infeksjoner har en sesongavhengig trend med høyere forekomst om vinteren (32). Det var derfor interessant å se hvordan tidsaspektet påvirket antallet infeksjoner i denne studien. Interaksjonsleddet var den viktigste forklaringsvariabelen i modellen, som viste at samspillet mellom avdelingstypen og antallet sykepleierstillinger var signifikant. I de midterste seks månedene har avdelinger med flere sykepleierstillinger dessuten flere infeksjoner. Vi kan tolke dette dit hen at sykepleiere i større grad oppdager og rapporterer inn infeksjoner.
Avdelingstype er det signifikante funnet som har størst assosiasjon med infeksjonsforekomst. De siste seks månedene økte infeksjoner i korttidsavdelingene. Årsaken kan være at flere på korttidsavdelinger blir lagt inn med en infeksjon.
I de midterste seks månedene hadde korttidsavdelingene færre infeksjoner enn langtidsavdelingene. Det er vanskelig å finne en forklaring på dette, men forskjellige faktorer ved pandemien kan ha påvirket resultatene våre. Norge opplevde færre infeksjoner og dødsfall enn det som normalt var forventet, i de første seks månedene av denne studien (33), sannsynligvis på grunn av vaksine mot covid-19 og strenge restriksjoner.
De midterste seks månedene hadde økende smitte og sykehusinnleggelser i løpet av høsten, noe som medførte nye nedstenginger (34). Norge opplevde en overdødelighet på 11,8 prosent i 2022 (33), da de siste seks månedene av denne studien ble gjennomført. Antallet smittede og sykehusinnleggelser steg til det høyeste gjennom hele pandemien (34).
Covid-19 kan ha påvirket organiseringen av sykehjemmene og ført til at flere pasienter som vanligvis ble lagt inn på korttidsavdelinger, heller ble lagt inn på sykehus eller egne covid-19-avdelinger. Sykehusinnleggelser er den eneste forklaringsvariabelen som holder seg konstant signifikant gjennom alle de tre tidsperiodene.
Likevel viser den trinnvise inkluderingen av variabler i regresjonsanalysen at sykehusinnleggelser har forskjellig forklaringskraft i modellen, og at de er den viktigste forklaringsvariabelen de siste seks månedene. Disse funnene styrker fortolkningene ovenfor. På tross av at sykehjem nå behandler mange infeksjoner selv og bruker mer intravenøs behandling (35), er flere beboere så syke at de må legges inn på sykehus for adekvat behandling (15).
Styrker og svakheter
Det er en svakhet at det er brukt selvrapporteringsskjema i studien vår. Det førte til at enkelte avdelinger har mange uker med manglende rapporteringer. I tillegg kan rapporteringene også ha blitt påvirket av den som leverte rapporten. Derfor gjenspeiler de nødvendigvis ikke hele virkeligheten.
Selv om de fleste rapportene ble levert samme uke som rapporten gjaldt for, hadde de mulighet til å etterrapportere. Det kan ha ført til hukommelsesskjevhet (recall bias), at de ikke husker korrekt hvor mange infeksjoner som var til stede, tilbake i tid. En annen svakhet er at vi ikke fulgte enkeltbeboere over tid, så vi vet ikke hvilke utfall infeksjonene fikk, og om det var enkelte beboere som hadde infeksjoner flere ganger.
Covid-19 kan også ha påvirket resultatene. Sykdommen førte til perioder med høyere smittetrykk enn normalt, men den førte også med seg strenge restriksjoner for å forhindre smitte. Konsekvensen var perioder med færre smittsomme sykdommer enn normalt i den norske befolkningen.
Likevel har denne studien sin styrke i at den har ukentlige rapporteringer over 18 måneder, noe som gjør at studien kan vise infeksjonsraten over tid, og ikke kun presenterer et øyeblikksbilde. Studien inkluderer mange ulike sykehjemsavdelinger fra ni forskjellige sykehjem. I tillegg inkluderte studien alle typer infeksjoner og er ikke kun begrenset til de vanligste helsetjenesteassosierte infeksjonene.
Konklusjon
Funnene fra denne studien viser at de fleste infeksjonene beboerne på sykehjem hadde, oppsto på sykehjemmet. Infeksjoner kan forårsake lidelse for beboere på sykehjem. De fører til sykehusinnleggelser og øker risikoen for død. Flere av infeksjonene kunne ha vært unngått med bedre infeksjonsforebygging. Kontinuerlig overvåkning av infeksjoner på sykehjem må prioriteres for at man raskt skal få kontroll på mulige infeksjonsutbrudd.
Den store andelen infeksjoner som behandles med antibiotika, som vi fant i studien vår, er overraskende. Økt kunnskap og oppmerksomhet om anbefalt behandling av infeksjoner på sykehjem vil kanskje være med på å redusere den høye antibiotikabruken i disse institusjonene. Redusert bruk av antibiotika er et nasjonalt mål og vil også kunne bidra til å redusere antibiotikaresistensen.
Finansiering
Denne studien er del av et doktorgradsprosjekt som er finansiert av Norsk Sykepleierforbund, referansenummer 4207.
Forfatterne oppgir ingen interessekonflikter.
Åpen tilgang CC BY 4.0
Hva studien tilfører av ny kunnskap
















0 Kommentarer