Retningslinjer økte bruk av enteral ernæring til intensivpasienter
Innføring av retningslinjer medførte at intenisvpasientene fikk mer enteral og mindre parenteral ernæring.
Bakgrunn: Ernæringsstøtte i form av enteral eller parenteral ernæring er viktig for å unngå underernæring hos intensivpasienten. Riktig ernæringsstøtte har vært assosiert med redusert dødelighet, færre infeksjoner og forbedret helserelatert livskvalitet. En registrering av ernæringspraksis har vist at denne ikke er i tråd med med retningslinjene. Det er behov for å finne måter som sikrer en ernæringspraksis som er basert på oppdaterte anbefalinger.
Hensikt: Å undersøke om en intervensjon for å implementere retningslinjer for ernæring til intensivpasienten fører til tidligere oppstart av enteral fremfor parenteral ernæring, og om kalori- og proteinbehovet blir bedre dekket med enteral ernæring.
Metode: Studien er en prospektiv observasjonsstudie før og etter en intervensjon.
Resultat: Etter intervensjonen ble tidlig oppstart av enteral ernæring iverksatt hos flere intensivpasienter. Det var færre pasienter som fikk parenteral ernæring, og den ble oftere startet senere i pasientoppholdet etter intervensjonen. Som følge av at intensivpasientene fikk mer enteral og mindre parenteral ernæring etter intervensjonen, ble større andel av kalori- og proteinbehovet dekket med enteral ernæring.
Konklusjon: Intervensjonen bidro til implementering av retningslinjer og en endring i praksis, som førte til at intensivpasientene fikk mer enteral og mindre parenteral ernæring.
Introduksjon
Intensivpasienter er utsatt for underernæring fordi kritisk sykdom påvirker kroppens normale metabolisme. I tillegg til at pasientene ofte ikke kan ta til seg næring ved å spise og drikke (1). Ernæringsstøtte i form av enteral ernæring (EN) eller parenteral ernæring (PN), er derfor viktig for å unngå underernæring, som er forbundet med økt sykelighet, økt dødelighet og forlenget sykehusopphold (2–6). I tillegg er riktig ernæringsstøtte assosiert med helserelatert livskvalitet (2). Det er identifisert tre retningslinjer for hvordan intensivpasientene bør ernæres (2,7–10). The Canadian Critical Care Practice Guidelines (CCPG) er blant de nyligst oppdaterte kunnskapsbaserte retningslinjene (2,7). I CCPG anbefales det at intensivpasienter får EN fremfor PN. Videre anbefales det oppstart av EN innen 24–48 timer etter innleggelse på intensivavdelingen (7). En slik tidlig oppstart av EN assosieres med mindre infeksjoner og forbedret overlevelse (3,11), mens tidlig PN assosieres med økt risiko for infeksjoner (3,12,13). Intensivpasienten kan imidlertid ha kontraindikasjoner eller intoleranse mot EN. I slike tilfeller er det ikke hensiktsmessig å følge anbefalingene om at EN er foretrukket ernæringsstøtte (12). Fordi bruk av PN har ført til ulike resultater i forskjellige studier er det usikkert når PN bør startes (12). Derimot anbefaler man å ikke starte med PN før alle strategier for å ernære pasienten enteralt er forsøkt (2,7).
Til tross for at det er utarbeidet retningslinjer som anbefaler tidlig oppstart av EN til intensivpasienten, er det beskrevet stor forskjell mellom anbefalt og reell praksis (2,14). Flere studier har evaluert effekten av å implementere retningslinjer for ernæring til intensivpasienten ved å måle ernæringspraksis opp mot anbefalt praksis. I tillegg er det målt dødelighet, respiratortid, forekomst av infeksjoner, liggetid på intensivavdelingen og på sykehus (14–18). I de fleste studiene ble ernæringspraksis forbedret, men kun i få studier hadde dette en effekt på pasientresultater (14–18). Manglende påvist forbedring i pasientresultater i studiene kan skyldes at det ikke ble oppnådd en tilstrekkelig forbedring av ernæringspraksis (19). Når intervensjoner gir dårligere resultater enn forventet, kan det skyldes at tiltaket ikke er så virksomt som forventet, eller at implementeringen var mislykket (20, 21). Det har derfor vært en økende interesse for hvordan praksis best kan forbedres (21). Til tross for økende interesse og forskning på området, finnes det likevel ingen entydig oppskrift på hvordan man skal lykkes med implementering (20–23).
Implementering av retningslinjer innebærer at retningslinjene innføres og etterfølges i klinisk praksis. Dette er avhengig av en kompleks interaksjon mellom ulike hemmende og fremmende forhold (14,23,24). Disse forholdene kan være relatert til selve retningslinjen, den enkelte helsearbeider, organisasjonen, pasienten og selve implementeringsprosessen (14,23,24). Prosessen er beskrevet som komplisert og utfordrende (2,14,19,21–27). Det virker som en multifaktoriell tilnærming med et sett av tiltak rettet mot barrierer er mest effektivt (20). I flere studier har økt oppmerksomhet på ernæring, undervisning og bruk av algoritmer vært assosiert med økt EN til pasientene (15,29–33).
Det er ikke grunn til å tro at vi er bedre til å etterleve retningslinjer i Norge enn internasjonalt. I forbindelse med deltakelse i den kanadiske kartleggingsstudien: «International Nutrition Survey 2011» (INS) (5,7,28), avslørte man at ernæringspraksis ved flere norske intensivavdelinger ikke var i tråd med anbefalt praksis ut fra forskning og CCPG (28). Det største avviket var at pasientene på intensivavdelingen fikk lite EN og mye PN sammenliknet med de 184 andre deltakende intensivavdelingene og anbefalinger (28).
Hensikten med denne studien er å undersøke om en intervensjon for å implementere retningslinjer for ernæring til intensivpasienten fører til tidligere oppstart av EN fremfor PN og om intensivpasientens kalori- og proteinbehov blir bedre dekket med EN.
Metode
Design
Studien er en prospektiv observasjonsstudie før og etter en intervensjon. Data om ernæringspraksis og dekningen av pasientenes ernæringsbehov ble sammenliknet fra 20 pasienter før intervensjon (2011-gruppen) og 20 pasienter fire måneder etter intervensjon (2012-gruppen).
Inklusjon og datasamling
Pasientene på intensivavdelingen ble fortløpende inkludert til to grupper, den ene fra mai 2011 og den andre fra september 2012 inntil kravet om 20 pasienter i hver gruppe ble oppnådd. Data samlet i forbindelse med deltakelsen i INS ble benyttet for å beskrive praksis før intervensjonen (2011-gruppen). Samme metode ble benyttet for å beskrive praksis etter intervensjonen (2012-gruppen). Inklusjonskriteriene var:
- 18 år eller eldre
- intubert innen 48 timer etter innleggelse
- inneliggende på avdelingen i minimum 72 timer
Data ble samlet fra pasientenes observasjonskurver og elektronisk pasientjournal fra innleggelse på intensivavdelingen og i tolv dager fremover, eller inntil pasienten ble utskrevet fra avdelingen. Tid fra innleggelse til oppstart av EN og PN ble registrert av studiesykepleier for å undersøke om oppstartstidspunktene var i henhold til anbefalinger i retningslinjen. Videre ble følgende variabler hentet fra observasjonskurve:
- Kalori- og proteininntak fra EN, PN og eventuelt oralt inntak
- Kalori fra glukoseløsninger og propofol
- Proteiner fra alanylglutamin (dipeptiven)
- Respiratortid
- Vekt og høyde
- Alder og kjønn
- Følgende variabler ble hentet fra elektronisk pasientjournal:
- Innleggelsesårsak og diagnose
- Parameter for beregning av Apache II score
- Overflytting og utskrivingstidspunkt
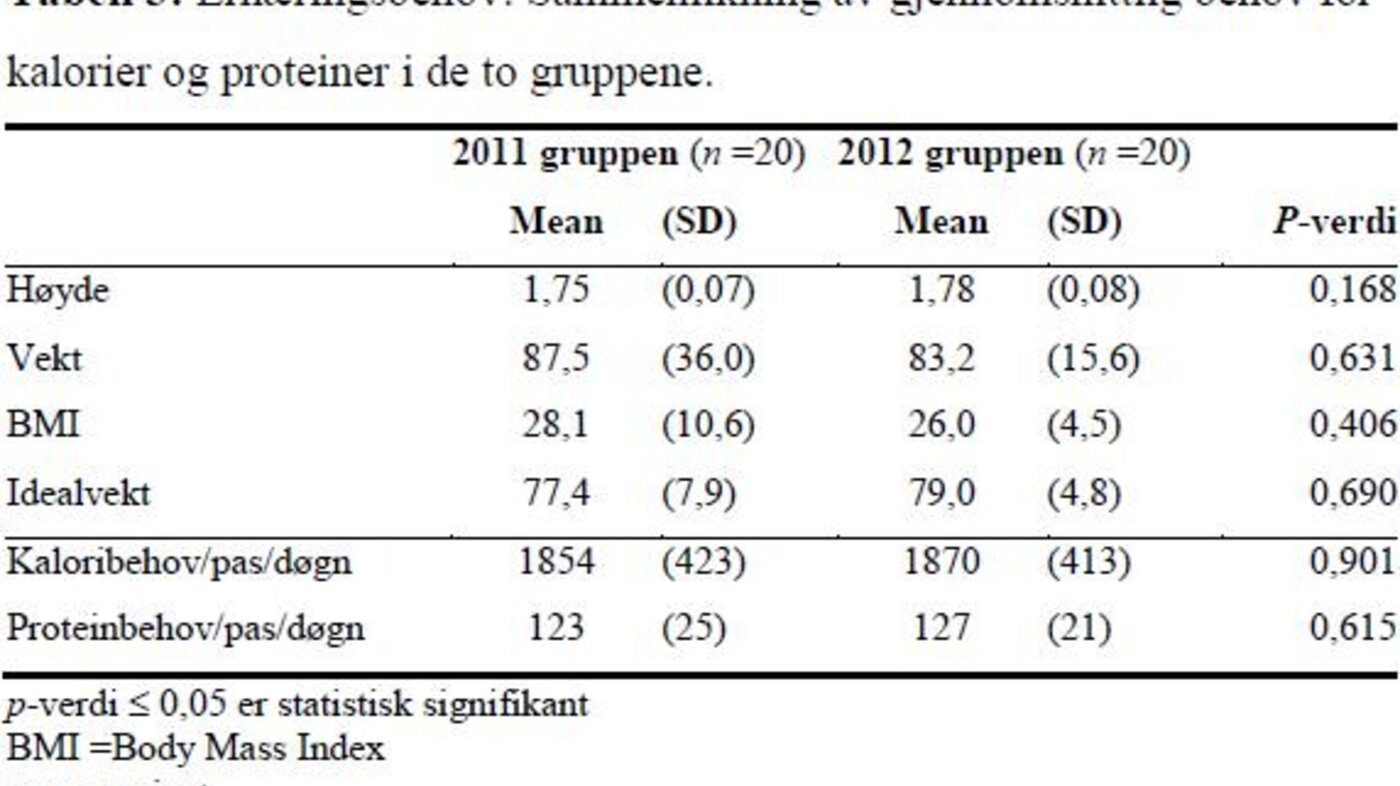
Pasientens døgnbehov for kalorier (kcal) ble utregnet ved innleggelse: I katabol fase 20 kcal/kg/døgn, i anabol fase 25 kcal/kg/døgn, ved dialysebehandling 30 kcal/kg/døgn. Døgnbehovet for proteiner ble også utregnet: Ved dialysebehandling 2 g/kg/døgn og ellers 1,5 g/kg/døgn. Pasientvekten ble anslått da pasientene ikke ble veid på avdelingen. Ved BMI over 30 ble ernæringsbehovet beregnet ut fra idealvekten, slik avdelingens retningslinje anbefaler.
Intervensjon
Studien er utført på en norsk intensivavdeling som hovedsakelig behandler traumepasienter og kirurgiske pasienter. Avdelingen har cirka 90 fast ansatte spesialsykepleiere for å bemanne ti intensivplasser. Legebemanningen består av et titalls faste intensivleger på dagtid og flere anestesileger som rullerer på vakttid.
I studien ble kvalitetsforbedringsmodellen Demings sirkel, også kalt PUKK-modellen (planlegge, utføre, kontrollere, korrigere) benyttet i kvalitetsforbedringsarbeidet (34). Etter en gjennomgang av praksisregistreringen fra deltakelsen i INS og ernæringsretningslinjen, ble en intervensjon for å forbedre praksis planlagt av et tverrfaglig team. Fra mars til mai 2012 ble følgende tiltak utført:
- Ernæringsalgoritme: Avdelingens tekstbaserte retningslinje var i overensstemmelse med CCPG og ble derfor ikke revidert. En ny og forenklet ernæringsalgoritme ble derimot utarbeidet på bakgrunn av CCPG (7) og en algoritme som hadde vist seg effektiv i en annen norsk studie (32). Denne ble hengt opp på samtlige pasientstuer.
- Intensivsykepleierne fikk to timers undervisning om betydningen av å starte EN tidlig og PN først etter fire dager.
- Tilbakemelding av praksisregistrering: Resultatene fra praksisregistreringen i forbindelse med INS ble presentert under undervisningen.
- Intensivlegene hadde et ernæringsmøte hvor resultatene fra INS ble presentert. I møtet ble det enighet om å forordne EN tidlig og PN etter fire dager.
- Informasjon om ernæring til intensivpasienten ble lagt ut på avdelingens intranettside.
- Påminnelser om ønsket ernæringspraksis ble gitt i form av postere i avdelingen og muntlige påminnelser i vaktskiftene.
- Veiledning i klinikken ble gitt i forhold til ønsket praksisendring i tråd med ernæringsretningslinjen og algoritmen.
Analyse
Data ble analysert ved hjelp av statistikkprogrammet PASW Statistics 18. Karakteristikker av de to gruppene (2011 og 2012) ble sammenliknet ved hjelp av frekvenser og andeler for kategoriske variabler, og gjennomsnitt, standardavvik (SD) og 95 prosent konfidensintervall (KI) for kontinuerlige variabler. Forskjeller mellom gruppene ble testet med uavhengig to-utvalgs t-test ved kontinuerlige variabler og Fisher`s exact test ved kategoriske variabler. Grense for statistisk signifikans ble satt til 5 prosent (35,36).
Etiske overveielser
Kvalitetsforbedringsstudien var ikke meldepliktig til REK. Studien og bruk av anonymiserte data er godkjent av personvernombudet ved Oslo universitetssykehus (OUS) og av avdelingens ledelse. Data ble lagret på sykehusets forskningsserver.
Resultat
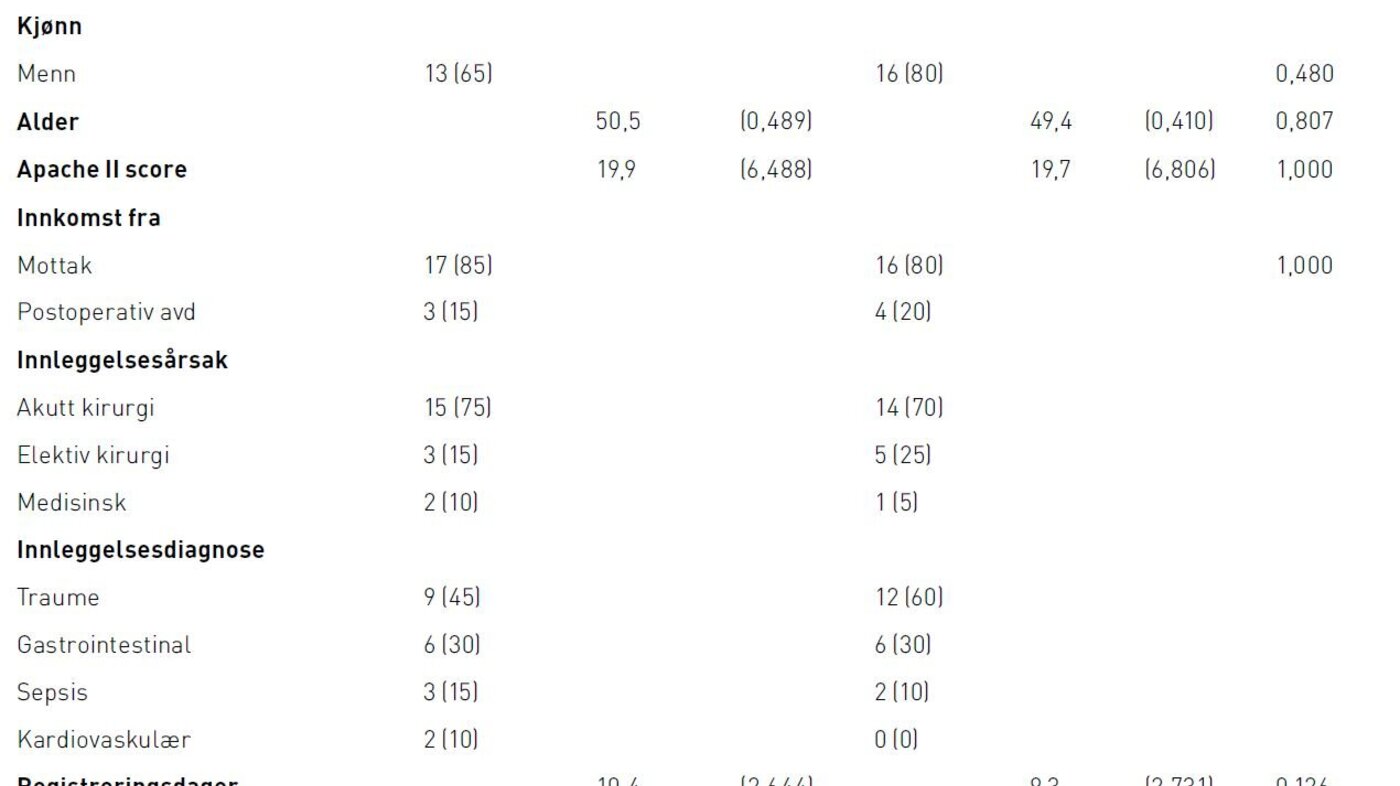
Det var ikke signifikante forskjeller i pasientkarakteristika i de to gruppene når det gjelder alder, innleggelsesdiagnose eller type innleggelse (tabell 1). Det var ingen statistisk signifikante forskjeller mellom pasientenes gjennomsnittlige ernæringsbehov eller parametere som påvirker behovet i de to gruppene. I 2011-gruppen fikk fire (20 prosent) og i 2012-gruppen fem (25 prosent) av pasientene dialysebehandling.
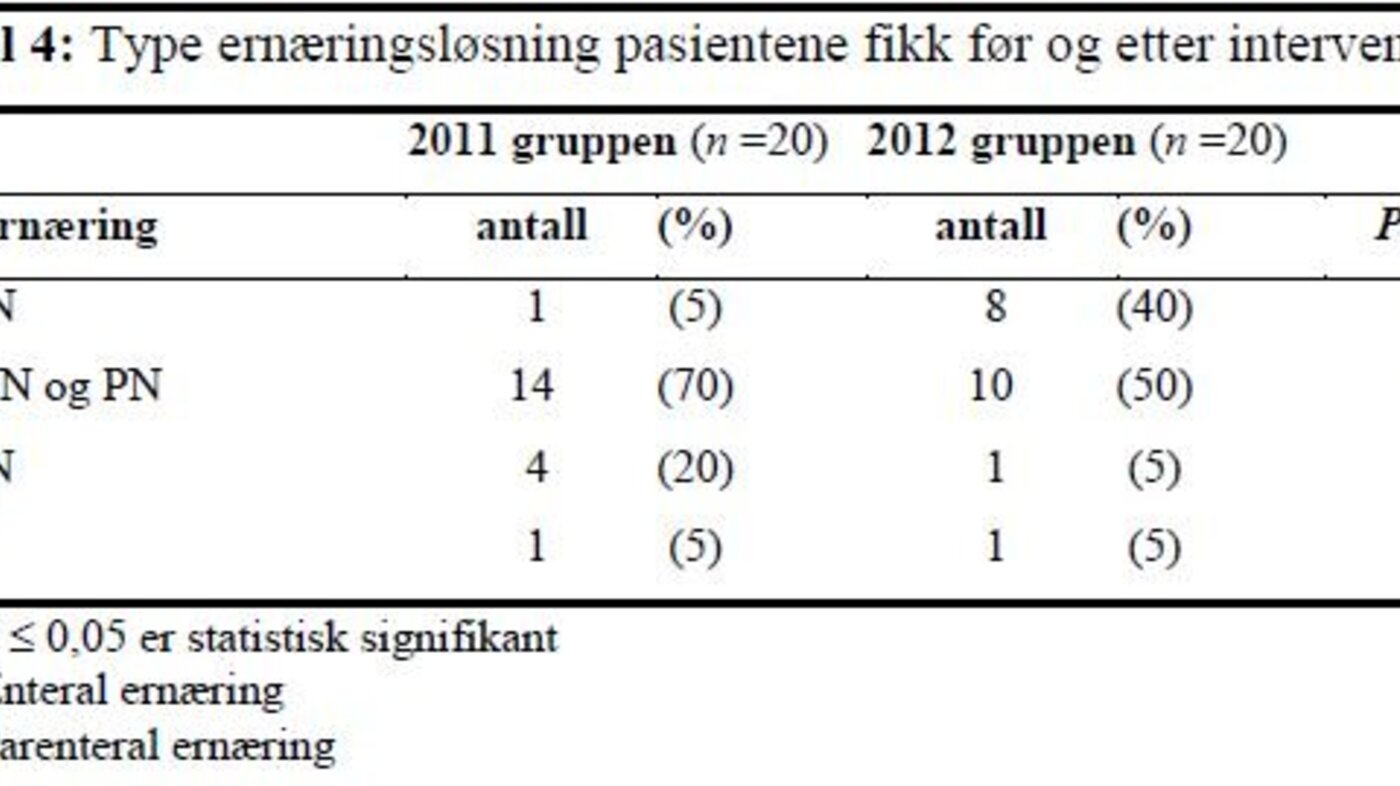
Det var en statistisk signifikant økning i andelen pasienter som bare fikk EN etter gjennomføringen av intervensjonen. Færre pasienter fikk EN og PN i kombinasjon eller kun PN i 2012-gruppen enn i 2011-gruppen, men dette var ikke statistisk signifikant.
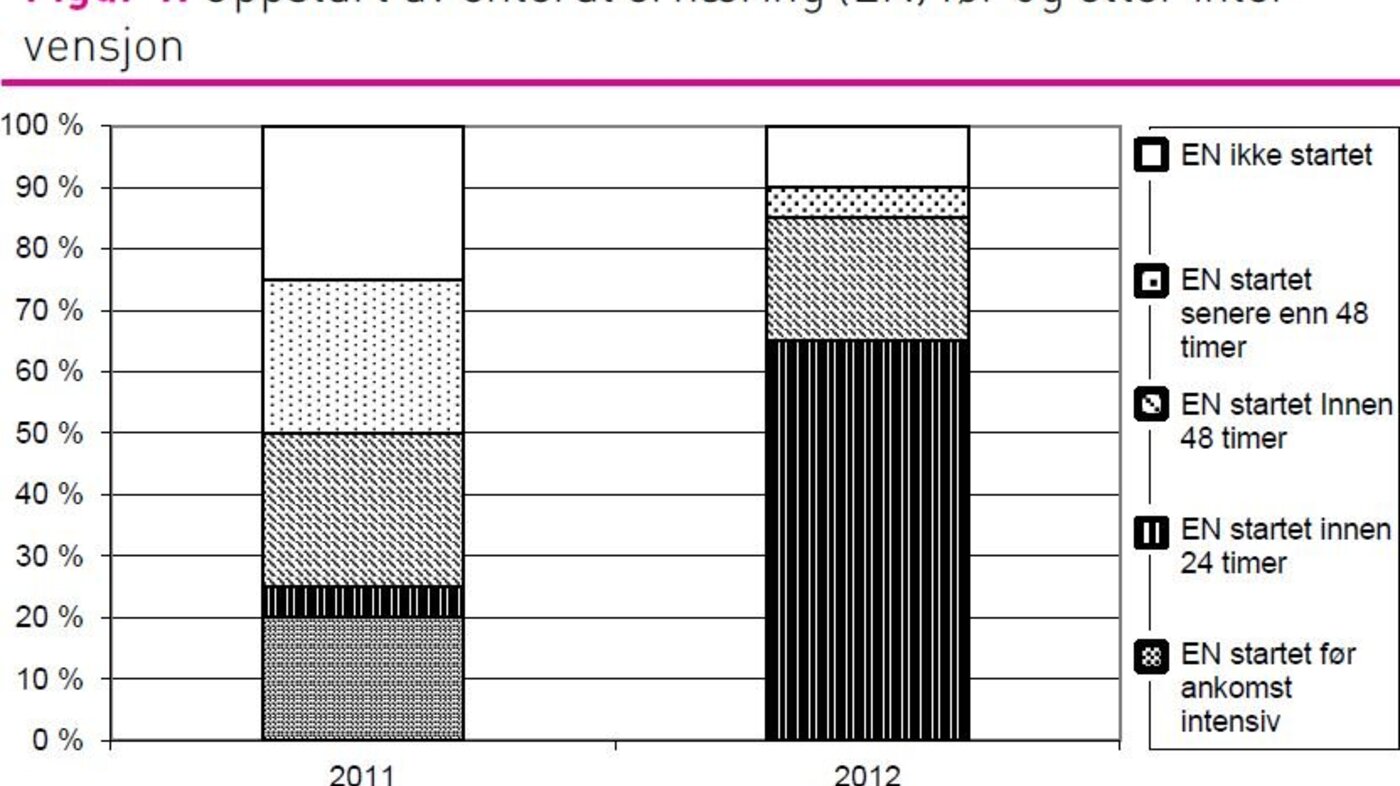
I 2011-gruppen fikk 15 pasienter (75 prosent) EN og i 2012-gruppen fikk 18 pasienter (90 prosent) EN (figur 1), men denne forskjellen var ikke signifikant. Oppstart av EN innen ankomst til avdelingen beskriver ikke intensivavdelingens praksis. Derfor ble bare de pasientene som fikk startet EN på intensivavdelingen inkludert i sammenlikning av oppstartstidspunktet for EN mellom gruppene. Det var en statistisk signifikant økning i andel pasienter som fikk EN innen 24 timer etter ankomst til intensivavdelingen, fra 9 prosent (n=11) i 2011-gruppen til 72 prosent (n=18) i 2012-gruppen (p = 0,001). Det var også en økning i andelen pasienter som fikk EN innen 48 timer etter ankomst til intensivavdelingen, fra 54 prosent i 2011 til 94 prosent i 2012 (p = 0,018) (figur 1).
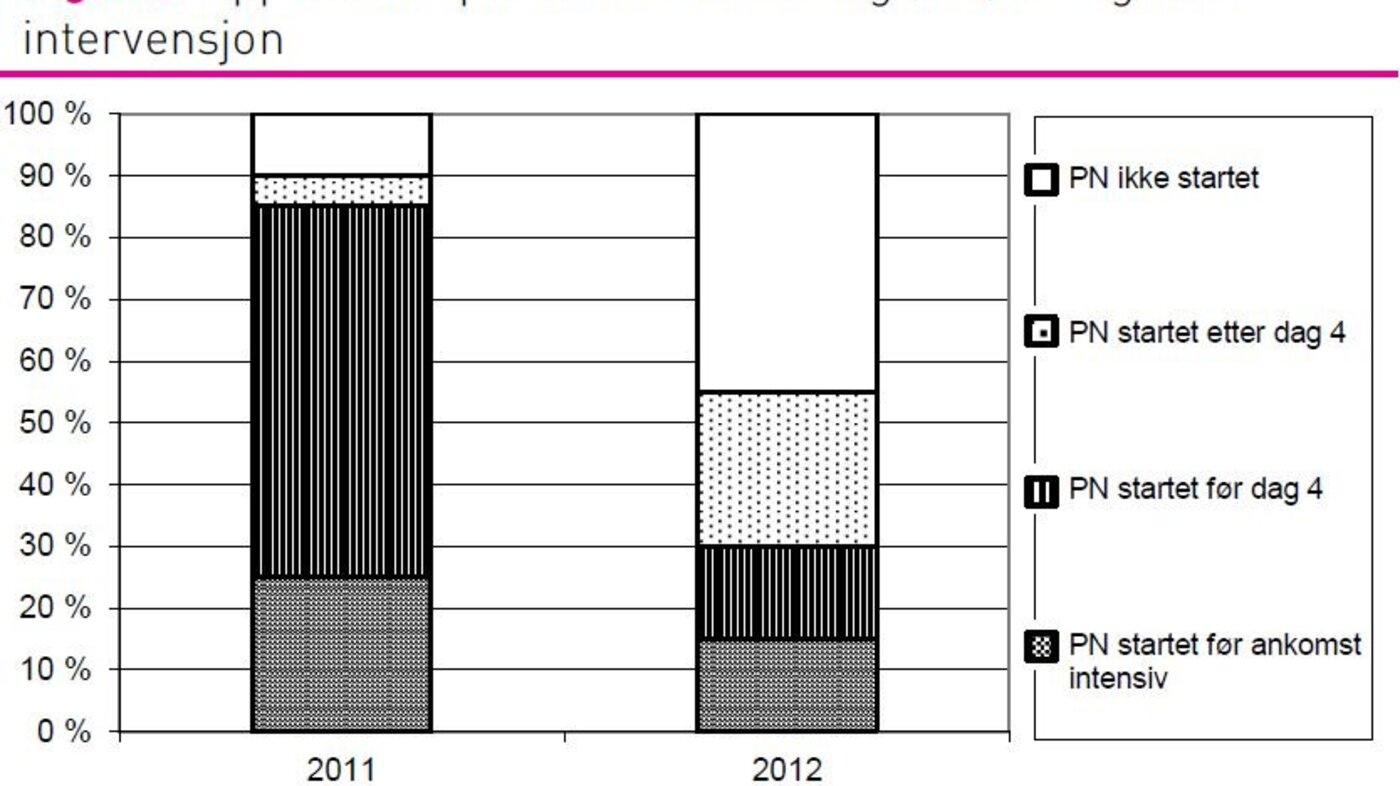
Andelen pasienter som fikk PN var redusert fra 90 prosent i 2011-gruppen til 55 prosent i 2012-gruppen (p = 0,031). Ved sammenlikning av pasienter som fikk startet PN på intensivavdelingen, var andelen pasienter som fikk PN tidlig (før dag 4) redusert fra 92 prosent (n=13) i 2011 til 37,5 prosent (n=8) i 2012 (p = 0,011) (figur 2).
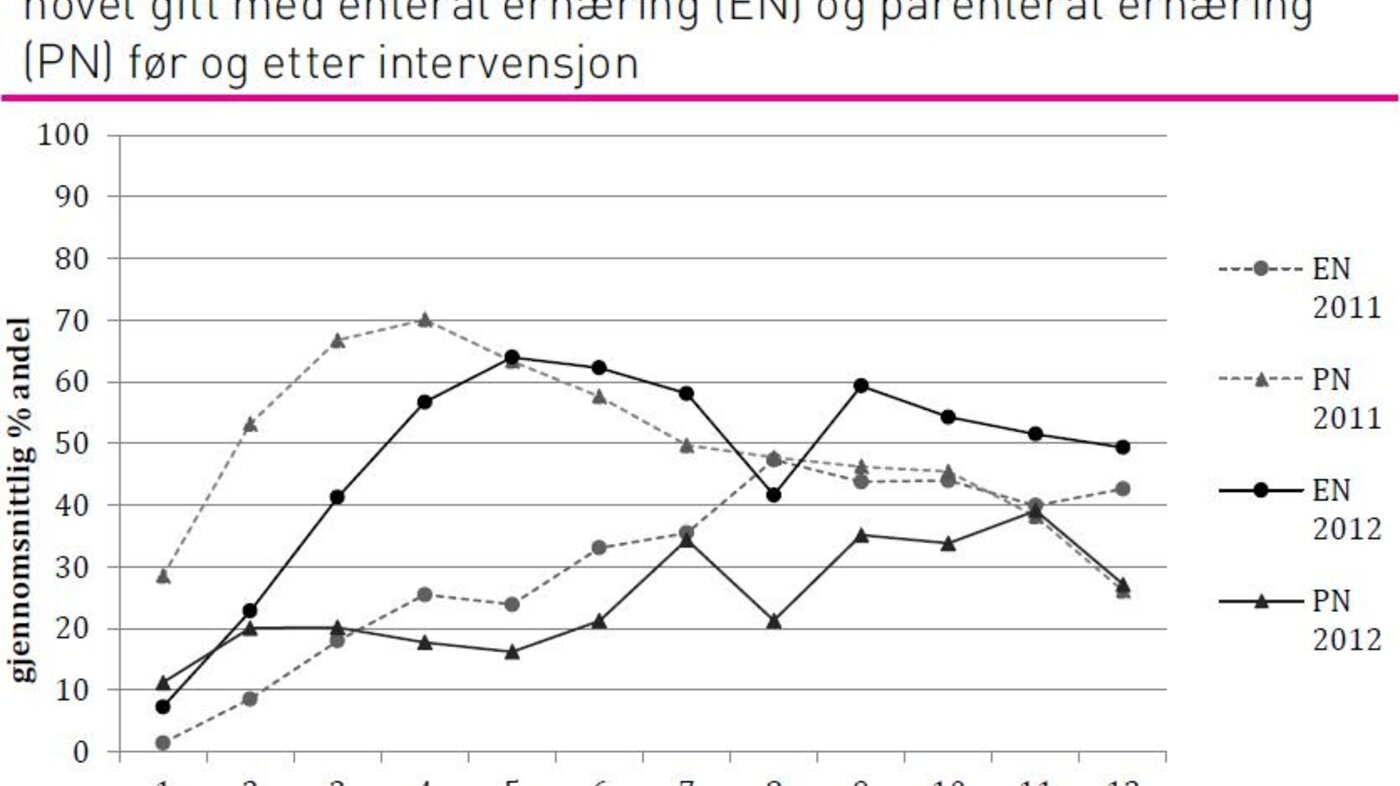
Det var statistisk signifikante forskjeller i mengde kalorier og proteiner pasientene fikk av EN og PN. Pasientene fikk mer EN og mindre PN i 2012-gruppen sammenliknet med 2011-gruppen. Det var ikke statistisk signifikant forskjell i gjennomsnittlig total mengde kalorier og proteiner pasientene fikk (tabell 2).
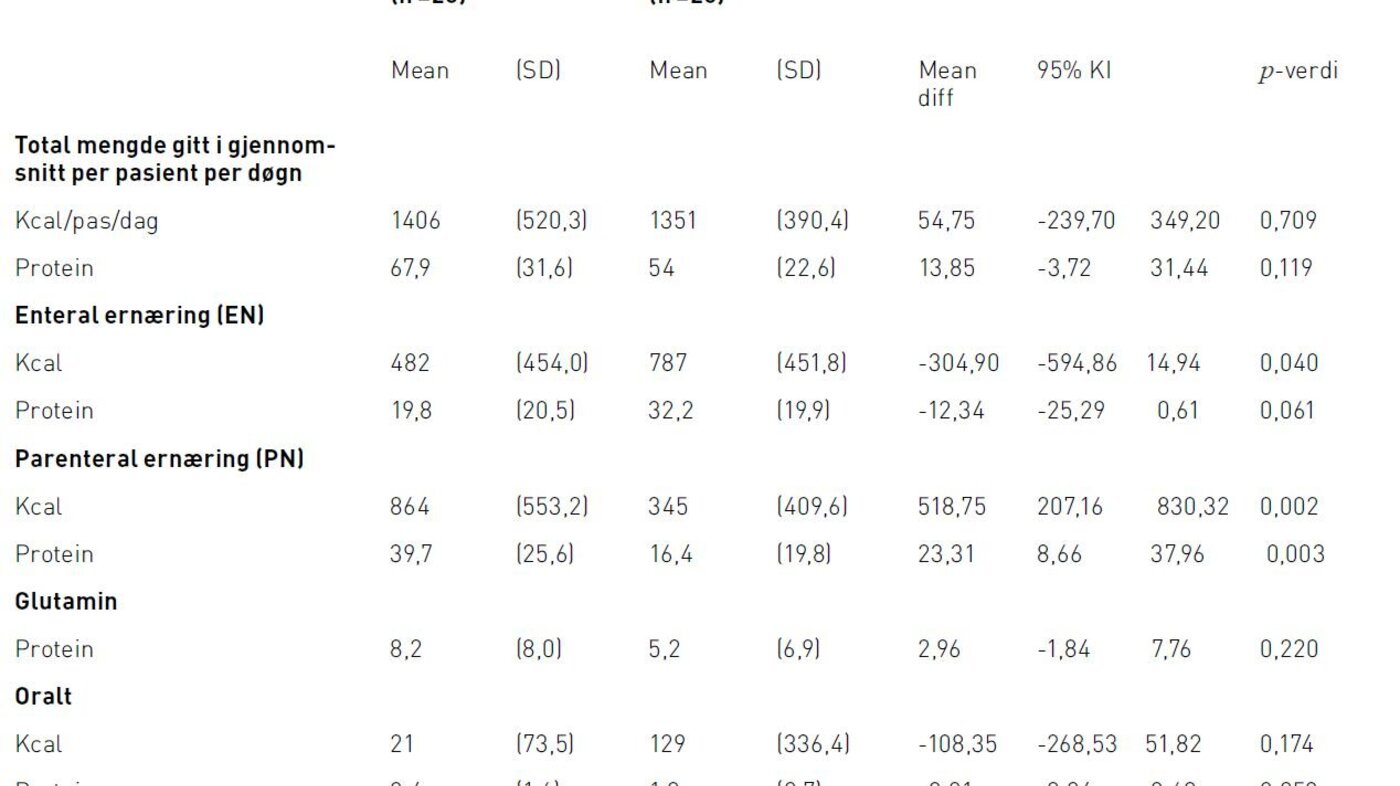
I 2011-gruppen var kaloribehovet dekket med en høyere andel PN enn EN. I 2012-gruppen var kaloribehovet dekket med en høyere andel EN enn PN. Der kaloribehovet ble dekket med EN var andelen høyest på dag fem i 2012-gruppen (63 prosent) og på dag åtte i 2011-gruppen (48 prosent) (figur 3). Andelen av proteinbehovet dekket med EN er høyest på dag fem i 2012-gruppen (40 prosent) og på dag åtte i 2011-gruppen (23 prosent). Pasientene fikk dekket mer enn 80 prosent av kaloribehovet fra dag tre i 2011-gruppen og fra dag fire i 2012-gruppen.
Diskusjon
Flere intensivpasienter fikk utelukkende EN, i tillegg til at EN ble startet opp tidligere i oppholdet etter intervensjonen. Færre pasienter fikk PN, og PN ble oftere startet etter dag fire i 2012-gruppen enn i 2011-gruppen. Intensivpasientene fikk mer EN og mindre PN etter intervensjonen. Som følge av endringen i praksis ble en høyere andel av intensivpasientens kalori- og proteinbehov dekket med EN fremfor PN.
I 2012 var 63 prosent av kaloribehovet dekket med EN på dag fem (figur 3). Dette er økning fra 2011-gruppen. Heyland beskriver at det anses som et kvalitetsmål at 80 prosent av ernæringsbehovet er dekket av EN (37). Dette kvalitetsmålet ble ikke oppnådd ved vår avdeling, eller i gjennomsnittet for de andre deltakende avdelingene i INS (28). Tilsvarende funn er gjort i en randomisert kontrollert studie som undersøkte forskjellen mellom passiv formidling og aktiv implementering av retningslinjer (17). Det kan være flere årsaker til at kvalitetsmålet på 80 prosent dekning ikke ble oppnådd. En årsak kan være at flere sykepleiere og leger ikke fulgte ernæringsalgoritmen. En topp på dag fem kan tyde på en tregere opptrapping enn forventet ut fra algoritmen og oppstartstidspunktet for EN (figur 2). I litteraturen er følgende mulige årsaker til at ansatte ikke følger retningslinjer beskrevet: At de ikke kjenner til algoritmens eksistens, mangler kunnskap og evner om hvordan de skal følge den eller rett og slett mangler vilje og motivasjon til å endre praksis. En annen årsak til at 80 prosent dekning ikke ble oppnådd kan være at ernæringsalgoritmen ikke var optimal, siden det ved retensjonsproblemer ble anbefalt en rask reduksjon av EN i stedet for gradvis nedtrapping (38). Fordi ernæringsbehovet er beregnet likt for de 12 dagene og ikke tar høyde for endringer i behov over tid, kan dette være en feilkilde. Litteraturen anbefaler en gradvis opptrapping av ernæringsmengden over noen dager (3). Dette kan medføre en kunstig lavere dekning av behovet de første dagene. I studien er det ikke justert for at pasientene på utskrivelsesdagen er på avdelingen i kun noen timer på grunn av avreise. De kan dermed ikke få dekket hele døgnbehovet på avreisedagen. Dette kan ha påvirket dekningsgraden.
Flere faktorer ved intervensjonen kan ha bidratt til å endre praksis og forbedre ernæringen til intensivpasienten. For det første besto intervensjonen av ulike aktive og passive tiltak. Aktive tiltak er beskrevet som mer effektive enn passive tiltak (21,23,25). Det å inkludere flere tiltak med ulike tilnærmingsmetoder har vist seg mer effektivt enn ett enkelttiltak (2,22,23). Dette gjør det imidlertid vanskelig å avgjøre om ett tiltak er mer utslagsgivende enn ett annet (20,21). For det andre var implementeringen planlagt og utført av et tverrfaglig team. Tverrfaglig samarbeid er beskrevet som en viktig faktor for å lykkes med å endre praksis (26). Det tverrfaglige teamet utarbeidet ernæringsalgoritmen, noe som kan ha bidratt til en felles forståelse mellom legene og sykepleierne om hvordan ernæring skal administreres. Dette kan i seg selv ha påvirket etterlevelse av retningslinjene. Til tross for at retensjonsgrensen i algoritmen ble redusert fra den som ble brukt i 2011, fikk pasientene i 2012-gruppen mer EN. Flere studier har vist at implementering av algoritmer har ført til en forbedret ernæringspraksis ved at pasientene får mer EN (29–33, 39).
Kontekst og avdelingens kultur har også betydning for implementering (20). I studiens intensivavdeling var det å arbeide kunnskapsbasert kjent fra tidligere og noe man hadde kultur for. Dette kan ha hatt betydning for resultatene i denne studien.
Betydningen av en tidlig oppstart av EN ble påpekt i undervisningen og på legenes ernæringsmøte. Det er beskrevet at undervisning har liten til ingen effekt på implementering (21). Til tross for dette økte andelen pasienter som fikk tidlig oppstart av EN fra 54 prosent i 2011-gruppen til 94 prosent i 2012-gruppen i denne studien. Litt av grunnen til at vi tror at undervisning kan ha hatt effekt, er at de ansatte fikk tilbakemelding om at etterlevelsen av kunnskapsbaserte retningslinjer var lav (resultatene fra INS). Tilbakemelding på egen praksis kan i seg selv settes i sammenheng med personlig overbevisning, motivasjon og vilje til å endre praksis. Selv om effekten av praksisregistrering og tilbakemelding på etterlevelse av retningslinjer er beskrevet som liten til moderat (40), kan det virke som om effekten er bedre der etterlevelsen er lav (21, 40).
Påminnelser i form av informasjon, postere og veiledning i klinikken ble utført for å opprettholde oppmerksomheten på temaet ernæring til intensivpasienten etter undervisningen. I en systematisk oversikt beskrives effekten av klinisk veiledning på implementering som liten til moderat (41). Kombinasjonen av påminnelser sammen med praksisregistrering og tilbakemelding er vist å være mest effektiv på implementering (20). Dette kan ha påvirket resultatene i denne studien.
Man kan ikke utelukke at forbedring i ernæringspraksis i denne studien kan skyldes andre forhold enn intervensjonen (36). Det var blant annet uvisst om det var forskjell i andelen pasienter med kontraindikasjoner mot EN i de to gruppene. Endring i oppstartstidspunkt for PN og mengden PN gitt, fremstår som den største endringen etter implementeringen. Andre forhold i avdelingen kan ikke forklare denne endringen av praksis, noe som støtter antakelsen om at endringen har sammenheng med intervensjonen. En eventuell tilfeldig skjevfordeling av pasienter med kontraindikasjoner mot EN kan eventuelt forklare endringen i forhold til oppstart av EN. Den kan derimot ikke forklare endringen i oppstartstidspunktet for PN.
Randomiserte kontrollerte studier (RCT) anses som gullstandard for å måle effekt av tiltak, og det er antydet at effekten av kvalitetsforbedringstiltak overestimeres i observasjonsstudier (20). Ved små utvalg er det risiko for å undervurdere forskjeller (36). I denne studien ble det allikevel oppnådd statistisk signifikante forskjeller i effektmålene mellom de to gruppene. Datasamlingen er utført på samme måte i 2011 og 2012-gruppene. Ernæringsdata ble samlet fortløpende fra observasjonskurven, og studiesykepleiers aktivitet med datainnsamling kan ha bidratt til økt oppmerksomhet på ernæring hos de ansatte og dermed påvirket praksis. Den manglende kontrollen på slike forhold kan kanskje forklare hvorfor denne studien og andre mindre observasjonsstudier viser til bedre effekt enn RCT’er.
I denne studien ble den siste praksisregistreringen (2012-gruppen) utført fire måneder etter intervensjonen. En registrering på et senere tidspunkt kunne ha gitt et bedre resultat fordi de ansatte tilpasser seg endring i forskjellig hastighet (42,43) og implementering tar tid (20, 27). På den annen side kunne resultatene blitt dårligere fordi oppmerksomheten mot ernæring kan falle etter avsluttet intervensjon og de ansatte faller tilbake til gamle vaner (20). Alexander beskriver i en systematisk oversikt at mange kvalitetsforbedringsstudier måler effekten kort tid etter gjennomføring av en intervensjon og at det dermed kan være vanskelig å vite om forbedringen opprettholdes over tid (20). Praksisregistreringen utført ved datasamlingen i 2012-gruppen kan gi ny tilbakemelding til praksis som forhåpentligvis kan føre til ytterligere oppmerksomhet og forbedringer. Det er beskrevet at fullstendig implementering av retningslinjer kan ta opp til tre år, og et realistisk mål for forbedring er omdiskutert (25). Arbeidet er derfor ikke avsluttet, men medfører ny runde i kvalitetsforbedringsmodellen.
Konklusjon
Intervensjonen i denne observasjonsstudien bidro til implementering av retningslinjer for ernæring og en endring i praksis som førte til at intensivpasientene fikk mer enteral ernæring og mindre parenteral ernæring. Å måle etterlevelse av kunnskapsbaserte retningslinjer kan bidra til å identifisere avvikende praksis. Slik informasjon er viktig tilbakemelding til de ansatte og for planlegging av lokalt tilpassede forbedringstiltak. Selv om denne intervensjonen forbedret ernæringspraksis vil det antakelig være nødvendig med gjentatte målinger og intervensjoner for å opprettholde god ernæringspraksis til intensivpasienten.
Vi ønsker å rette en stor takk til Kjetil Sunde intensivoverlege og professor, Nina Meidell intensivoverlege og Hilde Sporsem klinisk farmasøyt for fantastisk samarbeid i arbeidet med kvalitetsforbedringsprosjektet. Vi takker også avdelingsledelsen ved Nina Nysveen og Gunnar Morten Grømer for godkjenning av prosjektet ved Generell intensiv Ullevål, OUS.
Referanser
1. Stubberud D-G. Ernæring. I: Gulbrandsen T, Stubberud D-G. (red) Intensivsykepleie. [Oslo]: Akribe; 2. Utgave. 2010. p. 164–96.
2. Dhaliwal R, Cahill N, Lemieux M, Heyland DK. The Canadian critical care nutrition guidelines in 2013: an update on current recommendations and implementation strategies. Nutr Clin Pract. 2014 Feb;29:29–43.
3. Casaer MP, Van den Berghe G. Nutrition in the Acute Phase of Critical Illness. N Engl J Med. 2014;370:1227–36.
4. Doig GS, Heighes PT, Simpson F, Sweetman EA. Early enteral nutrition reduces mortality in trauma patients requiring intensive care: a meta-analysis of randomised controlled trials. Injury. 2011 Jan;42:50–6.
5. Heyland D, Dhaliwal R, Drover J, Gramlich L, Dodek P. Canadian clinical practice guidelines for nutrition support in mechanically ventilated, critically ill adult patients. Journal of Parenteral and Enteral Nutrition. 2003;27:355–73.
6. Sena MJ, Utter GH, Cuschieri J, Maier RV, Tompkins RG, Harbrecht BG, et al. Early supplemental parenteral nutrition is associated with increased infectious complications in critically ill trauma patients. J Am Coll Surg. 2008 Oct;207:459–67.
7. Critcal Care Nutrition. Canadian Clinical Practice Guidelines 2013. DRAFT Summary of Revisions to the Recommendations. 2013 [updated 02.07.2013.; cited 2014 25.05.]. Available from:http://criticalcarenutrition.com/docs/cpgs2012/Summary%20CPGs%202013%20….
8. McClave SA, Martindale RG, Vanek VW, McCarthy M, Roberts P, Taylor B, et al. Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). JPEN J Parenter Enteral Nutr. 2009 May-Jun;33:277–316.
9. Kreymann KG, Berger MM, Deutz NE, Hiesmayr M, Jolliet P, Kazandjiev G, et al. ESPEN Guidelines on Enteral Nutrition: Intensive care. Clin Nutr. 2006 Apr;25:210–23.
10. Singer P, Berger MM, Van den Berghe G, Biolo G, Calder P, Forbes A, et al. ESPEN Guidelines on Parenteral Nutrition: intensive care. Clin Nutr. 2009 Aug;28:387–400.
11. Doig GS, Heighes PT, Simpson F, Sweetman EA, Davies AR. Early enteral nutrition, provided within 24 h of injury or intensive care unit admission, significantly reduces mortality in critically ill patients: a meta-analysis of randomised controlled trials. Intensive Care Med. 2009 Dec;35:2018–27.
12. Seres D. Nutrition support in critically ill patients: An overview. http://www.uptodate.com [updated Nov 21. 2013.; cited 2014 03.05.]. Available from: http://www.uptodate.com/contents/nutrition-support-in-critically-ill-pa….
13. Casaer MP, Mesotten D, Hermans G, Wouters PJ, Schetz M, Meyfroidt G, et al. Early versus late parenteral nutrition in critically ill adults. N Engl J Med. 2011 Aug 11;365:506–17.
14. Cahill NE, Heyland DK. Bridging the guideline-practice gap in critical care nutrition: a review of guideline implementation studies. JPEN J Parenter Enteral Nutr. 2010 Nov-Dec;34:653–9.
15. Castro MG, Pompilio CE, Horie LM, Verotti CC, Waitzberg DL. Education program on medical nutrition and length of stay of critically ill patients. Clin Nutr. 2012 Dec 5.
16. Doig GS, Simpson F, Finfer S, Delaney A, Davies AR, Mitchell I, et al. Effect of evidence-based feeding guidelines on mortality of critically ill adults: a cluster randomized controlled trial. JAMA. 2008 Dec 17;300:2731–41.
17. Jain MK, Heyland D, Dhaliwal R, Day AG, Drover J, Keefe L, et al. Dissemination of the Canadian clinical practice guidelines for nutrition support: results of a cluster randomized controlled trial. Crit Care Med. 2006 Sep;34:2362–9.
18. Martin CM, Doig GS, Heyland DK, Morrison T, Sibbald WJ. Multicentre, cluster-randomized clinical trial of algorithms for critical-care enteral and parenteral therapy (ACCEPT). CMAJ. 2004 Jan 20;170:197–204.
19. Jones NE, Heyland DK. Implementing nutrition guidelines in the critical care setting: a worthwhile and achievable goal? JAMA. 2008 Dec 17;300:2798–9.
20. Alexander JA, Hearld LR. What can we learn from quality improvement research? A critical review of research methods. Med Care Res Rev. 2009 Jun;66:235–71.
21. Flottorp S, Aakhus E. Implementeringsforskning: vitenskap for forbedring av praksis. Norsk Epidemiologi 2013;23:187–96.
22. Baker R, Camosso-Stefinovic J, Gillies C, Shaw Elizabeth J, Cheater F, Flottorp S, et al. Tailored interventions to overcome identified barriers to change: effects on professional practice and health care outcomes. Cochrane Database of Systematic Reviews. 2010;(3):CD005470.
23. Francke AL, Smit MC, de Veer AJ, Mistiaen P. Factors influencing the implementation of clinical guidelines for health care professionals: a systematic meta-review. BMC Med Inform Decis Mak. 2008;8:38.
24. Cahill NE, Murch L, Cook D, Heyland DK. Improving the provision of enteral nutrition in the intensive care unit: a description of a multifaceted intervention tailored to overcome local barriers. Nutr Clin Pract. 2014 Feb;29:110-7.
25. National Institute for Health and Clinical Excellence. How to change practice 2007.
26. The McDonnell Norms Group. Enhancing the use of clinical guidelines: a social norms perspective. J Am Coll Surg. 2006 May;202:826-36.
27. Graham ID, Logan J, Harrison MB, Straus SE, Tetroe J, Caswell W, et al. Lost in knowledge translation: time for a map? J Contin Educ Health Prof. 2006 Winter;26:13-24.
28. Murch L. International nutrition survey 2011 Final Site Report. Improving the Practice of Nutrition Therapy in the Critically ill: An International Quality Improvement Project. Personlig meddelelse: Critical Care Nutrition; 2011. p. 28.
29. Kiss CM, Byham-Gray L, Denmark R, Loetscher R, Brody RA. The impact of implementation of a nutrition support algorithm on nutrition care outcomes in an intensive care unit. Nutr Clin Pract. 2012 Dec;27:793–801.
30. Baldonado A, Naqvi Mugler A, Garland A, Sherck J, Chin DE, Ely R, et al. Evidence-based practice strategy: increasing timely nutrition in mechanically ventilated trauma surgical patients. Dimens Crit Care Nurs. 2011 Nov-Dec;30:346–55.
31. Dobson K, Scott A. Review of ICU nutrition support practices: implementing the nurse-led enteral feeding algorithm. Nurs Crit Care. 2007 May-Jun;12:114–23.
32. Woien H, Bjork IT. Nutrition of the critically ill patient and effects of implementing a nutritional support algorithm in ICU. J Clin Nurs. 2006 Feb;15:168–77.
33. Bowman A, Greiner JE, Doerschug KC, Little SB, Bombei CL, Comried LM. Implementation of an evidence-based feeding protocol and aspiration risk reduction algorithm. Crit Care Nurs Q. 2005 Oct-Dec;28:324-33; quiz 34–5.
34. Kunnskapssenteret. Modell for forbedring – Langley/ Nolan. 2007.
35. Pallant J. SPSS survival manual: a step by step guide to data analysis using IBM SPSS. Maidenhead: McGraw-Hill; 2013. XIV.
36. Polit DF, Beck CT. Nursing research: generating and assessing evidence for nursing practice. Philadelphia, Pa.: Wolters Kluwer Health; 2012. Ninth edition. XIV.
37. Heyland DK. Critical care nutrition support research: lessons learned from recent trials. Curr Opin Clin Nutr Metab Care. 2013 Mar;16:176–81.
38. Heyland DK, Cahill NE, Dhaliwal R, Wang M, Day AG, Alenzi A, et al. Enhanced protein-energy provision via the enteral route in critically ill patients: a single center feasibility trial of the PEP up protocol. Crit Care. 2010;14:R78.
39. Wøien H. Klarer sykepleiere å ernære intensivpasienten tilfredsstillende? Sykepleien Forskning. 2009 (4):278-86.
40. Ivers N, Jamtvedt G, Flottorp S, Young JM, Odgaard-Jensen J, French SD, et al. Audit and feedback: effects on professional practice and healthcare outcomes. Cochrane database of systematic reviews. 2012;6:CD000259.
41. O›Brien MA, Rogers S, Jamtvedt G, Oxman AD, Odgaard-Jensen J, Kristoffersen DT, et al. Educational outreach visits: effects on professional practice and health care outcomes. Cochrane database of systematic reviews (Online). 2007 (4):CD000409.
42. Søreide E, Morrison L, Hillman K, Monsieurs K, Sunde K, Zideman D, et al. The formula for survival in resuscitation. Resuscitation. 2013 Aug 3.
43. Rogers EM. Diffusion of innovations. New York: Free Press; 2003. XXI.















0 Kommentarer