Få pasienter opplever postoperativ kvalme etter dagkirurgi med multimodal kvalmestillende behandling
Sammendrag
Bakgrunn: Dagkirurgi utgjør omtrent 60 prosent av all elektiv kirurgi i Norge og innebærer at pasienten møter til operasjon og reiser hjem igjen samme dag. Postoperativ kvalme er et kjent problem etter anestesi og kirurgi som kan forårsake ubehag og i verste fall komplikasjoner for pasienten. I en dagkirurgisk setting kan postoperativ kvalme i tillegg lede til forlenget liggetid eller behov for sykehusinnleggelse, noe som gir økte kostnader. Internasjonale studier viser at 37–57 prosent av pasientene rapporterer om postoperativ kvalme etter hjemkomsten i forbindelse med dagkirurgi.
Hensikt: Å undersøke hvor stor andel av våre dagkirurgiske pasienter som opplever postoperativ kvalme etter hjemkomsten. Vi ønsket også å undersøke om noen pasientgrupper er spesielt utsatt.
Metode: Studien er en tverrsnittsstudie. Vi brukte telefonoppfølging første postoperative dag som metode for å innhente data ved hjelp av et strukturert spørreskjema med faste svaralternativer.
Resultat: Totalt 2952 pasienter ble inkludert i studien, og svarresponsen var 99 prosent. Alle pasientene fikk generell anestesi i form av total intravenøs anestesi. Ut fra kjente risikofaktorer hadde majoriteten av utvalget en forhøyet risiko for å utvikle postoperativ kvalme. Studien viste en forekomst av postoperativ kvalme dagen etter operasjonen på 16 prosent, hvorav 14 prosent var litt kvalme og kun 2 prosent var mye kvalme.
Konklusjon: Studien viser at forekomsten av postoperativ kvalme etter dagkirurgi trolig kan reduseres ved å bruke systematisk multimodal kvalmeprofylaktisk behandling.
Referer til artikkelen
Stjernberg M, Rustøen T, Ræder J. Få pasienter opplever postoperativ kvalme etter dagkirurgi med multimodal kvalmestillende behandling. Sykepleien Forskning. 2018;13(71442):e-71442. DOI: 10.4220/Sykepleienf.2018.71442
Dagkirurgi utgjør i dag omtrent 60 prosent av all elektiv kirurgi i Norge, og innebærer at pasienten møter til operasjon og reiser hjem igjen samme dag. Ved å bruke anestesimidler som går hurtig ut av kroppen og blant annet lokalbedøvelse for å redusere smerte, blir pasienten raskt våken, mobilisert og klar for hjemreise. Det er både effektivt og kostnadsbesparende for å unngå sykehusinnleggelse av pasienter (1).
For at pasienten skal kunne reise hjem etter en dagkirurgisk operasjon, er de kliniske utskrivningskriteriene at vedkommende er sirkulatorisk og respiratorisk stabil, godt smertelindret, fri for kvalme, mobilisert, har spist og drukket samt har latt vannet (2).
Postoperativ kvalme
Den eksakte patofysiologien for kvalme og oppkast er kompleks, og mye er fortsatt uavklart (3). Begrepet Postoperative Nausea and Vomiting (PONV) er et samlebegrep som inkluderer kvalme og/eller oppkast etter operasjon (4, 5). I forbindelse med dagkirurgi kan postoperativ kvalme være årsak til forlenget opphold i avdelingen, sykehusinnleggelse (6) og forsinket retur til normal aktivitet og arbeid (7), som gir økte kostnader (8).
Kvalme kan også bidra til å redusere pasienttilfredsheten (8, 9). For dagkirurgiske pasienter kan postoperativ kvalme være spesielt problematisk siden de mangler umiddelbar tilgang til spesialisert helsehjelp og intravenøs kvalmestillende behandling etter utskrivelse (4). Kvalme kan forårsake problemer med å få i seg mat, drikke og medisiner. Oppkast kan i verste fall lede til sårruptur, blødning, aspirasjon og dehydrering (6).
Postoperativ kvalme og oppkast kan ved dagkirurgi også forekomme etter utskrivelse, såkalt Postdischarge Nausea and Vomiting (PDNV), selv hos pasienter som opprinnelig ikke var kvalme (7). Nyere forskning har vist at pasienter som opplevde postoperativ kvalme under oppholdet i avdelingen, har tre ganger så høy risiko for å utvikle PDNV (4), og at PDNV-forekomsten kan være så høy som 37–57 prosent etter dagkirurgi (4, 10, 11). For å illustrere omfanget av hvor mange pasienter som er utsatt for PDNV, viser vi til USA, der de utfører cirka 35 millioner dagkirurgiske operasjoner per år (4).
Predisponerende risikofaktorer og forebygging av postoperativ kvalme
Forskning har vist at predisponerende risikofaktorer for å utvikle PONV er å være kvinne (4, 5, 12), ikke-røyker (4, 5, 12), ha kraftig bevegelsessyke eller tidligere opplevelse av PONV (4, 5, 12), samt ha inntatt opioider postoperativt (4, 5, 12).
Ut fra disse faktorene laget Apfel og medarbeidere den såkalte Apfel score (12), som er et risikoskåringsverktøy for PONV. Jo flere risikofaktorer som er til stede, jo høyere er risikoen for PONV. Pasienter med alle fire risikofaktorene har en risiko for PONV på 80 prosent uten forebyggende behandling (12). Bruk av inhalasjonsanestesi eller lystgass samt langvarig anestesi har også vist seg å øke PONV-risikoen (5).
For å redusere risikoen for PONV anbefaler Gan og medarbeidere å dosere antiemetika individuelt etter anslått risiko, gi adekvat væsketerapi, minimere bruken av postoperative opioider ved å gi annen type smertebehandling samt bruke regional anestesi eller total intravenøs anestesi (TIVA) i stedet for inhalasjonsanestesi (13).
Det har vært diskutert hvorvidt spesielle kirurgiske prosedyrer er assosiert med økt risiko for PONV (5, 13). I Consensus Guidelines for the Management of Postoperative Nausea and Vomiting (SAMBA Guidelines) (13) beskrives en økt risiko knyttet til laparoskopiske inngrep (kikkhullskirurgi i buken), galleoperasjoner og gynekologiske operasjoner.
Apfel og medarbeidere (5) mener imidlertid at det er den laparoskopiske tilnærmingen som er utslagsgivende, og ikke type inngrep. Adekvat smertebehandling ser ut til å forebygge postoperativ kvalme (14, 15), og det er sett en sammenheng mellom postoperativ smerte, bruk av opioider og PDNV (10, 15).
I 2012 presenterte Apfel og medarbeidere en PDNV risikoskår (4) for å beregne hvor stor risiko pasienter har for å utvikle PDNV med disse risikofaktorene: forekomst av PONV under oppholdet i avdelingen (4, 10), å være kvinne (4, 10), alder < 50 år (4, 10), tidligere PONV (4, 10) og inntak av opioider under oppholdet i avdelingen (4, 10). Også her øker risikoen for PDNV med antallet risikofaktorer. Society for Ambulatory Anesthesiology (SAMBA) anbefaler begge risikoskåringsverktøyene til Apfel og medarbeidere (4, 12) i SAMBA Guidelines (13).
Hensikten med studien
Hensikten med studien vår var å undersøke hvor stor andel pasienter som opplevde PDNV etter dagkirurgi. Vi ønsket også å undersøke om det var noen forskjeller i kjønn og type operasjon.
Etter at avdelingen hadde implementert nye retningslinjer for målrettet, systematisk kvalmeprofylakse internt, ønsket vi å undersøke forekomsten og fordelingen av PDNV etter hjemkomsten i et stort og bredt pasientmateriale. Kunnskapen vil kunne ha betydning for videre arbeid med å forebygge og behandle postoperativ kvalme etter dagkirurgi.
Metode
Studien var en tverrsnittsstudie der vi samlet inn data ved Oslo universitetssykehus (OUS) fra september 2011 til august 2015. Dataene ble samlet inn i forbindelse med en telefonsamtale dagen etter operasjonen. Vi anvendte et strukturert spørreskjema (se vedlegg), som vi innhentet fra en annen dagkirurgisk avdeling. Den dagkirurgiske avdelingen ved OUS, hvor vi utførte studien, implementerte spørreskjemaet i 2011 som et kvalitetsforbedringstiltak.
Spørreskjemaet omhandler smerte, kvalme, blødning, mobilisering, søvn, informasjon og tilfredshet. Det består av ti spørsmål med faste svaralternativer. I tillegg inneholder det opplysninger om når operasjonen var utført, type operasjon, anestesiform og pasientens kjønn. Vi anvendte kun data om kvalme i denne studien. Spørsmålet om postoperativ kvalme lyder som følger: «Har du vært kvalm etter hjemkomst?» Pasienten vurderte selv sin kvalme ut fra svaralternativene «nei», «litt» eller «mye».
Inklusjonskriterier for telefonoppfølging
Inklusjonskriteriene for oppfølging via telefon var at pasienten hadde fylt 18 år og reiste hjem som planlagt etter operasjonen eller overnattet på vanlig pasienthotell uten medisinsk personell til stede. I tillegg måtte pasienten være i stand til å gjennomføre telefonsamtalen på norsk, svensk, dansk eller engelsk.
Datasamling
I denne studien valgte vi kun å se på pasienter som hadde fått generell anestesi i form av TIVA siden det var få pasienter som hadde mottatt annen type hovedanestesi. Pasienter som oppfylte inklusjonskriteriene, mottok spørreskjemaet ved utskrivelse etter den dagkirurgiske behandlingen. De ble informert om at vi ville innhente svarene i forbindelse med telefonoppfølging neste dag. Dersom operasjonen var på en fredag eller dag før helligdag, ringte vi opp pasienten førstkommende virkedag.
I forbindelse med oppringningen krysset sykepleieren av pasientens svar på et spørreskjema i papirformat. En ekstern spesialsykepleier la deretter inn dataene i et statistikkprogram. Manglende svar eller opplysninger ble kodet som «missing».
Sju faste postoperative sykepleiere foretok telefonoppfølgingen. Alle registrerte data gjelder pasientens tilstand det første døgnet etter hjemkomsten for å sikre sammenliknbare data. Ifølge prosedyren skal de som ringer, følge det samme spørreskjemaet og stille spørsmålene så likt som mulig.
Primærsykepleie ble praktisert ved avdelingen. For å sikre at pasientene følte seg frie til å si sin mening, ble de oppringt av en annen sykepleier enn den som hadde pasientansvaret på operasjonsdagen.
Anestesi, kvalmeprofylakse og forebyggende smertebehandling
Alle pasientene i studien mottok propofolbasert TIVA, som er kjent for å gi en rask oppvåkning. TIVA reduserer også PONV-risikoen de første timene etter operasjonen og gir mindre kvalme enn inhalasjonsanestesi (16–19). Remifentanil ble brukt som opioid. Pasientene ble ventilert med oksygen og luft. Peroperativt ble det i tillegg gitt opioidet fentanyl intravenøst og sårinfiltrasjon med lokalanestesi for å forebygge smerte.
Pasientene fikk peroperativ kvalmeprofylakse etter et internt, standardisert regime (tabell 1), laget av fagansvarlig for dagkirurgi i henhold til aktuell kunnskap og erfaring. Kvalmeprofylaksen besto av tre ulike medikamentkombinasjoner ut fra forventet kvalmerisiko i henhold til type kirurgisk inngrep. Noen pasientgrupper fikk i tillegg resept på et peroralt opioid (kodein, tramadol), alternativt ble noen tabletter sendt med hjem. Ved behov fikk pasientene også et potent opioid (oksykodon) med hjem etter inngrepet, for ett til tre døgns forbruk .
Premedikasjon i form av en kombinasjon av paracetamol og NSAID (Non-Steroidal Anti-Inflammatory Drug) eller COX-2-hemmer ble gitt som smerteprofylakse dersom det ikke var kontraindisert.
Postoperative smerter ble videre behandlet med fentanyl intravenøst, paracetamol og NSAID eller COX-2-hemmer samt perorale opioider ved behov. Pasientene fikk resept på paracetamol og NSAID eller COX-2-hemmer ved utskrivelsen.
Etiske overveielser
En sykepleier informerte pasienten om at det var frivillig å besvare spørreskjemaet, at svarene var anonyme, og at hensikten med undersøkelsen var intern kvalitetsforbedring. Dersom pasienten svarte på spørreskjemaet, ble det ansett som samtykke til å delta i undersøkelsen. For å ivareta taushetsplikten ble pasienten oppringt på sin egen mobiltelefon.
Personvernombudet ved OUS definerte undersøkelsen som kvalitetsforbedringsarbeid og vurderte den som ikke meldepliktig, da alle dataene var anonyme. Seksjonslederen for den dagkirurgiske avdelingen ga tillatelse til å publisere dataene. Studien innebar ikke noen form for ekstra intervensjoner.
Statistisk analyse
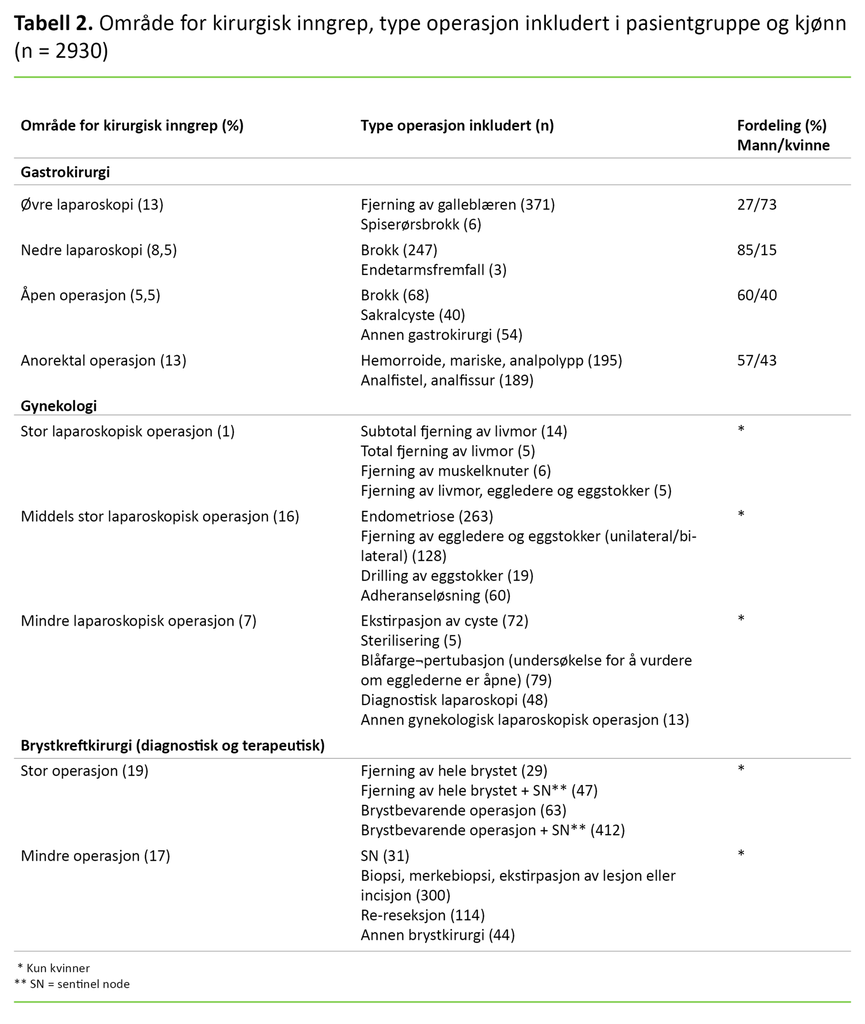
Vi delte inn pasientkategoriene i undergrupper etter type kirurgi, størrelse på operasjonen og forventet risiko for PONV (tabell 2). Inndelingen ble gjort i samråd med fagansvarlig for dagkirurgi ved sykehuset. I den bivariate analysen valgte vi å dikotomisere svaralternativene «nei», «litt» og «mye» til «ikke kvalm» og «kvalm» (litt og mye), da vi mente at forekomst eller fravær av kvalme var mest klinisk relevant for denne studien.
Vi utførte statistiske analyser ved å bruke IBM SPSS Statistics, versjon 22.0 (SPSS Inc., Chicago, IL, USA). Vi utførte frekvensanalyser for å beskrive utvalget og bivariate analyser med kjikvadrattest for å beskrive forekomsten av PDNV innenfor de ulike forklaringsvariablene. I analysen av resultatene som fremgår av tabell 3, brukte vi McNemar’s test for å påvise signifikans. Signifikansnivået ble satt til p < 0,05.
Resultater
Av totalt 3204 oppringte pasienter inkluderte vi 2952 pasienter i studien. Svarresponsen var 99 prosent, og datamaterialet inneholdt <5,5 prosent missing data. Kvinner utgjorde 79 prosent av de inkluderte pasientene, 40 prosent gjennomgikk gastrokirurgi, 24 prosent gynekologiske inngrep og 36 prosent brystkreftkirurgi (diagnostisk og terapeutisk).
Laparoskopiske inngrep i buken utgjorde totalt 46 prosent av alle kirurgiske inngrep. Område for kirurgisk inngrep, inndeling og fordeling vises i tabell 2. I noen få tilfeller kan anestesien ha blitt konvertert til inhalasjonsanestesi uten at dette er registrert, da inhalasjonsanestesi ikke var et avkrysningsalternativ i spørreskjemaet.
Kvalme etter hjemkomst og kirurgiske inngrep
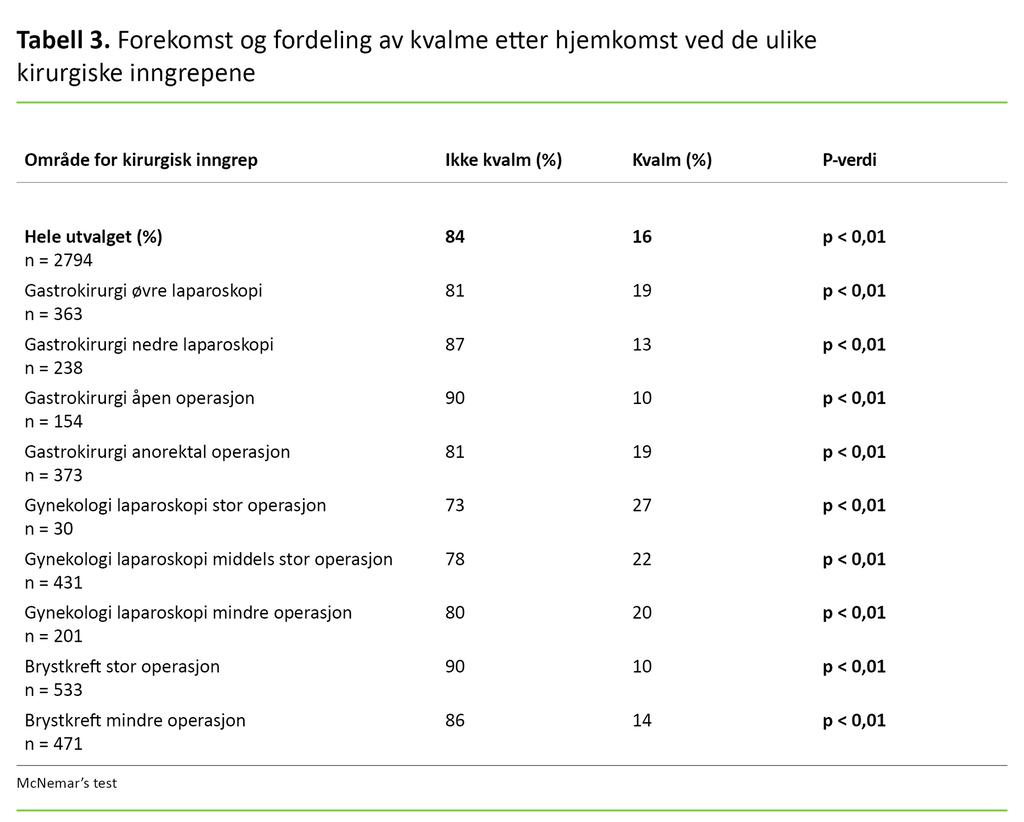
Totalt opplevde 16 prosent av de dagkirurgiske pasientene PDNV etter hjemkomsten. Av disse rapporterte 14 prosent at de var litt kvalme etter hjemkomsten, og 2 prosent opplevde mye kvalme. Da vi så på kvalme i henhold til kjønn, rapporterte 17 prosent av kvinnene og 12 prosent av mennene forekomst av PDNV (p < 0,05).
Pasienter som gjennomgikk gynekologisk laparoskopi, var mest utsatt for PDNV (20–27 prosent) (p < 0,01), etterfulgt av gastrokirurgiske øvre laparoskopier (19 prosent) (p < 0,01) og gastrokirurgiske anorektale operasjoner (19 prosent) (p < 0,01). Lavest PDNV-forekomst ble rapportert av brystkreftpasienter som hadde gjennomgått stor operasjon (10 prosent) (p < 0,01) (tabell 3).
Diskusjon
Det er utfordrende å sammenlikne forekomsten av PDNV i ulike studier grunnet forskjeller i pasientutvalg, anestesimetode, operasjonsteknikk, type operasjon og tidsangivelse for måling av PDNV. I tillegg har utviklingen innen anestesi og kirurgi vært stor det siste tiåret, noe som også påvirker sammenlikningsgrunnlaget.
Denne studien viste en total forekomst av PDNV på 16 prosent den første postoperative dagen etter dagkirurgi. Utvalget hadde en forhøyet risiko for PDNV ved at nesten 80 prosent var kvinner, og nærmere halvparten av operasjonene besto av laparoskopiske inngrep i buken, hvilket er assosiert med større risiko for postoperativ kvalme.
Apfel og medarbeidere (4) rapporterte om en PDNV-forekomst på 37 prosent de første 48 timene etter operasjon i en multisenterstudie med 2170 dagkirurgiske pasienter. Pasientene gjennomgikk forskjellige kirurgiske operasjoner. Majoriteten mottok profylaktisk antiemetika, og kvinner utgjorde en lavere andel enn i studien vår.
I studien til Apfel og medarbeidere (4) ble det gitt inhalasjonsanestesi til alle pasientene, noe som kan ha bidratt til den høyere forekomsten av PDNV. I studien vår fikk alle pasientene TIVA.
Kappen og medarbeidere (11) undersøkte 11 613 pasienter, som alle fikk adekvat kvalmeprofylakse. Kjønnsfordelingen var 50/50, og litt over halvparten fikk inhalasjonsanestesi. Utvalget var ifølge Kappen og medarbeidere (11) ikke noe utpreget høyrisikoutvalg og besto kun av elektive pasienter, der noen gjennomgikk dagkirurgi. Likevel var 41–43 prosent av pasientene kvalme de første 24 timene etter operasjonen, noe de mente var en uventet høy forekomst av PDNV.
Den forholdsvis lave forekomsten av PDNV i vår studie kan være et resultat av at alle pasientene fikk multimodal kvalmeprofylaktisk behandling med både propofolbasert TIVA og antiemetika etter et standardisert regime, med medikamenter som anbefales i SAMBA Guidelines (13). Individuell risikoskåring var ikke praksis ved avdelingen, slik at noen av pasientene trolig fikk mer antiemetika enn de skulle hatt ut fra antallet risikofaktorer, mens noen høyrisikopasienter sannsynligvis fikk for lite.
Høyest PDNV-forekomst hos gynekologiske pasienter
Kvinnene i studien vår rapporterte som forventet en høyere PDNV-forekomst enn mennene, som stemmer med tidligere forskning (4, 5, 10, 12). For inngrep på kvinner rapporterte de gynekologiske pasientene den høyeste forekomsten av PDNV (20–27 prosent) i materialet, mens brystkreftpasientene hadde lavest PDNV-forekomst (10–14 prosent). Chen og medarbeidere (20) beskriver en PDNV-forekomst på 14 prosent etter brystoperasjoner utført i TIVA, som samsvarer med vårt funn.
En medvirkende årsak til den høye PDNV-forekomsten hos de gynekologiske pasientene i vår studie kan være den kirurgiske tilnærmingen (5, 13). Paech og medarbeidere (21) presenterte et liknende resultat. De rapporterte om en kvalmeforekomst på 25 prosent etter gynekologisk laparoskopi ved bruk av TIVA kombinert med smerte- og kvalmeprofylakse.
Bruk av multimodal antiemetisk profylakse ble også vist av Scruderi og medarbeidere (22). Ved å bruke en multimodal antiemetisk tilnærming liknende vår rapporterte 12 prosent av pasientene PDNV etter gynekologisk laparoskopi, mens 32 prosent av pasientene som fikk inhalasjonsanestesi uten antiemetika, opplevde PDNV. Pasientene som fikk multimodal behandling, kunne også skrives ut raskere enn de andre pasientene i studien (22).
Pasientene som gjennomgikk gastrokirurgisk øvre laparoskopi, rapporterte om nest høyest forekomst av kvalme i vår studie, med 19 prosent PDNV. Majoriteten var kvinner, og kolecystektomier utgjorde 98 prosent av inngrepene, noe som predikerer en økt risiko for postoperativ kvalme.
I en annen studie (23) hvor de også anvendte en multimodal tilnærming inkludert TIVA og de fleste pasientene var kvinner, fant de en PDNV-forekomst på 20 prosent i forbindelse med laparoskopisk kolecystektomi, som er i overenstemmelse med vårt funn.
Mindre kvalme ved gastrokirurgisk nedre laparoskopi
De to gastrokirurgiske pasientgruppene med nedre laparoskopi og åpen operasjon viste lavere forekomst av kvalme enn de andre gastrokirurgiske pasientene i studien. Til tross for en laparoskopisk operasjonsmetode rapporterte pasientene med nedre laparoskopi om en lavere kvalmeforekomst enn pasienter med mindre brystkirurgiske inngrep.
En forklaring kan være at 99 prosent av inngrepene ved nedre laparoskopi var lyskebrokkoperasjoner, der man med nyere operasjonsteknikk opererer utenfor bukhinnen med såkalt total ekstraperitoneal tilgang (TEP). TEP er vist å være en skånsommere operasjonsteknikk (24) som kan tenkes å redusere risikoen for kvalme sammenliknet med de andre laparoskopiske inngrepene i studien, der man opererer innenfor bukhinnen. I gruppen med gastrokirurgisk åpen operasjon ble det stort sett utført mindre kirurgi.
Anorektal operasjon ga høy PDNV
Den høye PDNV-forekomsten etter gastrokirurgisk anorektal operasjon var uventet, da disse operasjonene anses for å være forholdsvis enkle og ukompliserte. I tillegg var majoriteten av pasientene menn. Vi hadde forventet at brystkreftpasientene, som var kvinner som gjennomgikk relativt store operasjoner, skulle være mer plaget med PDNV enn dem med anorektal operasjon.
Selv om anorektalgruppen fikk deksametason som kvalmeprofylakse, hvilket har vist seg å være effektivt (25), så var PDNV-forekomsten den samme som ved gastrokirurgisk øvre laparoskopi. Det er vanskelig å si hva som kan være årsaken til den høye PDNV-forekomsten, men postoperative smerter er et kjent problem etter anorektal kirurgi (26), hvilket kan gi kvalme (15). Mange av pasientene fikk dessuten med seg resept på peroralt opioid, som også kan ha bidratt til kvalme.
Til sammenlikning fant Coloma og medarbeidere (25) en PDNV-forekomst på 8 prosent etter anorektal operasjon, der deksametason var gitt som kvalmeprofylakse og operasjonene var utført med lokalbedøvelse og sedasjon. I studien vår fikk alle pasientene generell anestesi i form av TIVA. Det kan indikere mer omfattende kirurgi hos våre pasienter og behov for å forsterke kvalmeprofylakse til denne pasientgruppen.
PDNV og postoperativ smerte
PDNV-forekomsten synes å forbli relativt stabil til tross for ny kunnskap. En av årsakene kan være at utviklingen innen operasjon og anestesi har gjort det mulig å utføre større og mer kompliserte operasjoner dagkirurgisk, som kan tenkes å påvirke både smerteforekomsten og behovet for postoperative opioider (27).
Thagaard og medarbeidere (14) påpeker at non-opioid smertebehandling er viktig for å forebygge postoperativ kvalme. Ved å bruke et NSAID som inneholdt ketorolac peroperativt viste de en reduksjon av både smerte, opioidbehov og kvalme etter operasjonen.
Odom-Forren og medarbeidere (10) undersøkte forekomsten av PDNV den første uken etter operasjon hos 248 dagkirurgiske pasienter. De fant en total PDNV-forekomst på 57 prosent, noe som var betydelig høyere enn forventet. Av pasientene var 6 prosent fortsatt plaget med PDNV på postoperativ dag 7 (10). Odom-Forren og medarbeidere fant en sammenheng mellom PDNV og postoperativ smerte, ved at pasienter med høy smerteskår rapporterte om en høyere forekomst av PDNV (10, 15), og at årsaken sannsynligvis var en høyere opioidkonsumpsjon (10).
Studiens styrker og begrensninger
Studiens styrke er det store utvalget innenfor tre pasientgrupper og en høy svarrespons. I tillegg hadde alle pasientene fått samme type anestesi samt smerte- og kvalmeprofylakse etter et standardisert regime.
En begrensning ved studien er at spørreskjemaet som vi anvendte, inneholdt få bakgrunnsopplysninger om pasientene. For fremtiden vil det være viktig å få inkludert flere opplysninger om pasientene, for eksempel alder samt kjente risikofaktorer for å utvikle PONV eller PDNV. Dataene for postoperative smerter var ikke komplette og forhindret oss fra å undersøke koplingen mellom kvalme og smerte, noe som reduserte fortolkningsgrunnlaget. Videre bør forekomsten av oppkast registreres i forbindelse med opplysninger om PONV eller PDNV i og med at begrepene inkluderer både kvalme og oppkast.
Konklusjon
I denne studien hadde majoriteten av utvalget en forhøyet risiko for å utvikle PDNV. Likevel var det en forholdsvis lav andel som opplevde PDNV sammenliknet med andre nyere studier. Disse funnene kan tyde på at en systematisk, multimodal tilnærming til kvalmeprofylakse kan bidra til en lav forekomst av postoperativ kvalme etter dagkirurgi.
Kvinnene i studien rapporterte om høyere forekomst av kvalme enn mennene. I henhold til type inngrep var det flest pasienter med kvalme etter laparoskopiske inngrep, særlig etter gynekologisk laparoskopi, mens brystkreftpasienter med større operasjoner var minst kvalme. Pasienter med anorektale inngrep rapporterte om en uventet høy forekomst av kvalme, noe som bør følges opp videre.
For å kunne forebygge og redusere forekomsten av både PONV og PDNV bør forekomsten dokumenteres i henhold til risikofaktorer og profylakse gjennom hele pasientforløpet.
Referanser
1. Ræder J, Nordentoft J. Dagkirurgi og anestesi. Tidsskrift for Den norske legeforening. 2010;130(7):742–6.
2. Norsk anestesiologisk forening. Norsk standard for anestesi [internett]. Oslo: Norsk anestesiologisk forening, ALNSF; 2010 [sitert 06.05.2016]. Tilgjengelig fra: https://www.alnsf.no/alnsf/norsk-standard-for-anestesi.
3. Blackburn J, Spencer R. Postoperative nausea and vomiting. Anaesthesia & Intensive Care Medicine. 2015;16(9):452–6.
4. Apfel CC, Philip BK, Cakmakkaya OS, Shilling A, Shi Y-Y, Leslie JB, et al. Who is at risk for postdischarge nausea and vomiting after ambulatory surgery? Survey of Anesthesiology. 2013;57(1):1.
5. Apfel CC, Heidrich FM, Jukar-Rao S, Jalota L, Hornuss C, Whelan RP, et al. Evidence-based analysis of risk factors for postoperative nausea and vomiting. Br J Anaesth. 2012b;109(5):742–53.
6. Keyes M. Management of postoperative nausea and vomiting in ambulatory surgery: The big little problem. Clin Plast Surg. 2013;40(3):447–52.
7. Carroll NV, Miederhoff P, Cox FM, Hirsch JD. Postoperative nausea and vomiting after discharge from outpatient surgery centers. Anesth Analg. 1995;80(5):903–9.
8. Parra-Sanchez I, Abdallah R, You J, Fu AZ, Grady M, Cummings K 3rd, et al. A time-motion economic analysis of postoperative nausea and vomiting in ambulatory surgery. Can J Anaesth. 2012;59(4):366–75.
9. Odom-Forren J, Hooper V, Moser DK, Hall LA, Lennie TA, Holtman J, et al. Postdischarge nausea and vomiting: management strategies and outcomes over 7 days. J Perianesth Nurs. 2014;29(4):275–84.
10. Odom-Forren J, Jalota L, Moser DK, Lennie TA, Hall LA, Holtman J, et al. Incidence and predictors of postdischarge nausea and vomiting in a 7-day population. J Clin Anesth. 2013;25(7):551–9.
11. Kappen HT, Moons GMK, Van Wolfswinkel JL, Kalkman AC, Vergouwe AY, Van Klei AW. Impact of risk assessments on prophylactic antiemetic prescription and the incidence of postoperative nausea and vomiting: A cluster-randomized trial. Anesthesiology. 2014;120(2):343–54.
12. Apfel CC, Läärä E, Koivuranta M, Greim CA, Roewer N. A simplified risk score for predicting postoperative nausea and vomiting: conclusions from cross-validations between two centers. Anesthesiology. 1999;91(3):693.
13. Gan TJ, Diemunsch P, Habib AS, Kovac A, Kranke P, Meyer TA, et al. Consensus guidelines for the management of postoperative nausea and vomiting. Anesth Analg. 2014;118(1):85–113.
14. Thagaard KS, Jensen HH, Raeder J. Analgesic and antiemetic effect of ketorolac vs. betamethasone or dexamethasone after ambulatory surgery. Acta Anaesthesiol Scand. 2007;51(3):271–7.
15. Odom-Forren J, Rayens MK, Gokun Y, Jalota LM, Radke O, Hooper V, et al. The relationship of pain and nausea in postoperative patients for 1 week after ambulatory surgery. Clin J Pain. 2015;31(10):845–51.
16. Apfel CC, Korttila K, Abdalla M, Kerger H, Turan A, Vedder I, et al. A factorial trial of six interventions for the prevention of postoperative nausea and vomiting. The New England Journal of Medicine. 2004;350 (24):2441–51.
17. Yoo YC, Bai SJ, Lee KY, Shin S, Choi EK, Lee JW. Total intravenous anesthesia with propofol reduces postoperative nausea and vomiting in patients undergoing robot-assisted laparoscopic radical prostatectomy: a prospective randomized trial. Yonsei Med J. 2012;53(6):1197–202.
18. Eikaas H, Raeder J. Total intravenous anaesthesia techniques for ambulatory surgery. Curr Opin Anaesthesiol. 2009;22(6):725–9.
19. Kumar G, Stendall C, Mistry R, Gurusamy K, Walker D. A comparison of total intravenous anaesthesia using propofol with sevoflurane or desflurane in ambulatory surgery: systematic review and meta-analysis. Anaesthesia. 2014;69(10):1138–50.
20. Chen HP, Hsu YH, Hua KC, Lin CC, Lo YF, Yu HP. Comparison of sevoflurane versus propofol under auditory evoked potential monitoring in female patients undergoing breast surgery. Biomedical Journal. 2013;36(3):125–31.
21. Paech MJ, Rucklidge MWM, Lain J, Dodd PH, Bennett E-J, Doherty DA. Ondansetron and dexamethasone dose combinations for prophylaxis against postoperative nausea and vomiting. Anesth Analg. 2007;104(4):808–14.
22. Scuderi PE, James RL, Harris L, Mims GR 3rd. Multimodal antiemetic management prevents early postoperative vomiting after outpatient laparoscopy. Anesth Analg. 2000;91(6):1408–14.
23. Habib AS, White WD, Eubanks S, Pappas TN, Gan TJ. A randomized comparison of a multimodal management strategy versus combination antiemetics for the prevention of postoperative nausea and vomiting. Anesth Analg. 2004;99(1):77–81.
24. Nawaz T, Ayub MW, Murad F, Ali Q, Khan A, Anwar I. Comparison of laparoscopic total extra peritoneal (TEP) techniques versus transabdominal preperitoneal (TAPP) technique for inguinal hernia repair. Journal of Rawalpindi Medical College (JRMC). 2015;19(3):220–2.
25. Coloma M, Duffy LL, White PF, Kendall Tongier W, Huber PJ Jr. Dexamethasone facilitates discharge after outpatient anorectal surgery. Anesth Analg. 2001;92(1):85–8.
26. Vinson-Bonnet B, Higuero T, Faucheron JL, Senejoux A, Pigot F, Siproudhis L. Ambulatory haemorrhoidal surgery: systematic literature review and qualitative analysis. Int J Colorectal Dis. 2015;30(4):437–45.
27. Rawal N. Postoperative pain treatment for ambulatory surgery. Best Practice & Research Clinical Anaesthesiology. 2007;21(1):129–48.















0 Kommentarer