Kostnader ved masseundersøkelsen mot livmorhalskreft
Sammendrag
Bakgrunn: Forebygging står sentralt i norsk helsepolitikk, og observasjonsstudier tyder på at organisert screening har redusert forekomsten av livmorhalskreft i Norge. Samfunnets ressurser er imidlertid knappe.
Hensikt: Vår hensikt var å estimere de årlige kostnadene av Masseundersøkelsen mot livmorhalskreft.
Metode: Vi beregnet statens direkte utgifter og de årlige samfunnsøkonomiske kostnader av dagens screeningprogram for livmorhalskreft på grunnlag av opplysninger fra Kreftregisteret om antall utførte undersøkelser under Masseundersøkelsen for livmorhalskreft og enhetskostnadene for disse. De samfunnsøkonomiske enhetskostnadene er basert på ulike beregninger av faktiske kostnader, mens statens utgifter er basert på de ulike takstsystemer.
Resultater: I 2011 ble det utført i alt 360 704 primærscreeningprøver, som med våre beregninger ville medføre 21 783 nye etterundersøkelser. Det ble innsendt biopsier for omtrent 9000 kvinner, og 3057 kvinner fikk utført konisering. De samlete samfunnsøkonomiske kostnader ved screeningprogrammet var 730 millioner kroner, hvorav 52 prosent utgjorde indirekte kostnader i form av reisekostnader og fravær fra arbeid. Statens direkte utgifter utgjorde 163 millioner kroner.
Konklusjon: Det norske screeningprogrammet for livmorhalskreft har betydelige kostnader, der kvinnenes tids- og reisekostnader og legekonsultasjoner veier mest.
Referer til artikkelen
Pedersen K, Lönnberg S, Skare G, Sørbye S, Burger E, Kristiansen I. Kostnader ved masse­undersøkelsen mot livmorhals­kreft. Sykepleien Forskning. 2015;10(1):62-71. DOI: 10.4220/Sykepleienf.2015.53414
Introduksjon
Livmorhalskreft er globalt den fjerde vanligste kreftform blant kvinner (1), mens den er nummer 13 i forekomst i Norge (2). Kreftregisteret registrerte i 2011 302 nye tilfeller av invasiv livmorhalskreft, og samme år døde 66 kvinner av denne kreftformen (2). Livmorhalskreft skyldes infeksjon med humant papillomavirus (HPV). Livstidsrisikoen for å få HPV-infeksjon er anslått til cirka 75 prosent (3), men de fleste tilfeller av HPV-smitte er selveliminerende. De fleste HPV-typer er ufarlige eller framkaller vorter (såkalte lavrisiko HPV), men noen infeksjoner kan gi årsak til celleforandringer og etter hvert utvikling av invasiv kreft. Disse forandringene kan påvises ved celleprøve av livmorhalsen og histologisk undersøkelse (biopsi). Det antas at 12–14 typer av HPV kan forårsake livmorhalskreft (høyrisiko HPV) (4). Disse virusene forårsaker tilnærmet alle tilfeller av kreft i livmorhalsen (5). HPV forårsaker også vulvovaginal-, penis-, anal- og oropharyngealkreft (6). Det mangler foreløpig representative undersøkelser fra Norge, men det er antatt at prevalensen av HPV-smitte hos kvinner er 20–30 prosent i alderen 25–33 år, men synker til 8–12 prosent i alderen 34–69 år (7).
Masseundersøkelsen for livmorhalskreft ble innført i 1995 og innebærer cytologi-basert screening hvert tredje år for kvinner i alderen 25–69. Dersom celleprøven viser celleforandringer, henvises kvinnen til videre oppfølging, ofte kalt triage. Cytologiske forandringer kan påvises i celleprøve som med stigende alvorlighetsgrad benevnes ASC-US, LSIL, ASC-H eller HSIL (tabell 1). Norske retningslinjer anbefaler at pasienten henvises til kolposkopi med biopsi når celleprøven viser ASC-H eller HSIL, eller ved persisterende lavgradige celleforandringer eller HPV-positivitet. Biopsien graderes som normal, CIN1, CIN2, CIN3 eller kreft, der CIN2, CIN3 og invasiv kreft ofte omtales CIN2+ (tabell 1). I nesten alle land tilsier retningslinjene for forebygging av livmorhalskreft at CIN2/3 fjernes ved konisering eller alternativt en ablativ behandling av epitelet i spesielle tilfeller der risikoen for residiv er lav. Rasjonalet for livmorhalskreftscreening er nettopp å forebygge invasiv kreft ved å oppdage og behandle disse høygradige forstadiene.

Effekten av cytologiscreening på forekomsten av livmorhalskreft er ikke dokumentert i randomiserte studier, men observasjonsstudier tyder på en betydelig effekt (8–10). Da Kreftregisteret ble opprettet i 1953, ble det knapt utført cytologiske prøver i Norge, og den aldersjusterte insidens av livmorhalskreft var cirka 15 per 100 000 (11, figur 1). I 2005 var tallet sunket til 8 (12). Manglende oppmøte reduserer imidlertid populasjonseffekten av screening; mer enn halvparten av nye tilfeller av invasiv kreft påvises nå hos kvinner som ikke har tatt celleprøve det siste 3,5 års intervallet før diagnose (13). I dagens program får cirka 63 prosent av kvinnene tatt celleprøve det året de fyller 25 år eller innen det har gått tre år siden forrige prøve (14). Andelen øker til 76 prosent hvis vi inkluderer alle som får tatt prøve innen fem år fra forrige prøve. I tillegg viser tall fra Kreftregisteret en svak økning i antall krefttilfeller de siste ti årene for kvinner under 35 år (11).
Det er vanlig å anta at «prevention is better than cure», og forebygging står sentralt i arbeidet med ny helsepolitikk i Norge (15). Samfunnets ressurser er imidlertid knappe, og prioritering er derfor nødvendig. I pasientrettighetslovens paragraf 2–1 heter det at «retten (til helsehjelp) gjelder bare dersom pasienten kan ha forventet nytte av helsehjelpen, og kostnadene står i rimelig forhold til tiltakets effekt». Mulighetene for å erstatte cytologi med HPV-testing i primærscreening aksentuerer behovet for å få bedre kunnskap om kostnader og nytte ved Masseundersøkelsen mot livmorhalskreft. En fullstendig økonomisk evaluering omfatter tallfesting av så vel kostnader som effekter (16). Det siste er en omfattende oppgave, til dels fordi det er usikkerhet om hvor stor effekten av screening er og til dels fordi helsegevinstene ved screening for livmorhalskreft kan komme mange år etter at screeningprøven er tatt. Hensikten med denne studien er å beregne de årlige kostnadene ved dagens screeningsprogram.
Metode
Vi beregnet de årlige samfunnsøkonomiske kostnadene ved dagens screeningprogram for livmorhalskreft på grunnlag av opplysninger fra Kreftregisteret om antall utførte undersøkelser under Masseundersøkelsen for livmorhalskreft og enhetskostnadene for disse. I tillegg beregnet vi hvor store statens direkte kostnader ved programmet er.
Fra Kreftregisteret hentet vi informasjon om antall cytologiske prøver utført i 2011 for kvinner i screeningalder, det vil si 25–69 år. Disse ble deretter fordelt på primærscreening og sekundærscreening (triage). Registeret inneholder ikke opplysninger om hvorvidt prøvene er rekvirert av fastlege, privatpraktiserende spesialist eller sykehuspoliklinikk. Ettersom screeningprogrammet legger opp til at prøvene skal tas hos fastlege, antok vi derfor at 80 prosent av prøvene var tatt hos fastlege, mens de øvrige var tatt hos spesialist eller ved sykehuspoliklinikk. Dessverre finnes det ingen registerdata som kan bekrefte vårt anslag. Antall undersøkelser etter primærscreening ble basert på antall unormale (ASC-US og mer alvorlig) (tabell 1) og uegnete cytologiske prøver. Vi antok at legen gir beskjed per brev eller telefon til kvinnen om behov for oppfølgingsundersøkelse. Denne kan omfatte ny cytologisk prøve, HPV-test, og/eller kolposkopi og livmorhalsbiopsi, avhengig av funnet ved den primære cytologiske prøve (14). Antall kvinner som fikk utført biopsi og eventuelt påfølgende konisering, ble basert på Kreftregisterets data fra patologi-laboratoriene.
Vi beregnet både statlige og samfunnsøkonomiske enhetskostnader av aktiviteter som genereres som følge av screeningprogrammet (tabell 2). De samfunnsøkonomiske enhetskostnadene ble basert på ulike beregninger av faktiske kostnader, mens statens utgifter ble basert på de ulike takstsystemene: Innsatsstyrt Finansiering (DRG-systemet) (17,18) og Normaltariffen (19,20), og uttrykt med 2013 priser. Alle beregninger i kostnadsanalysen er basert på antakelsen om at celleprøver gjøres med væskebasert metode, men vi har ikke inkludert kostnadene ved biobank. Ettersom dekningen av væskebasert metode fortsatt begrenset seg til 40 prosent av screeningprøvene i 2013 og metoden er noe dyrere enn konvensjonelt utstryk, er de beregnete kostnadene høyere enn de faktiske kostnadene i dag. Likevel forventes de fleste laboratorier å gå over til væskebasert metode innen få år.
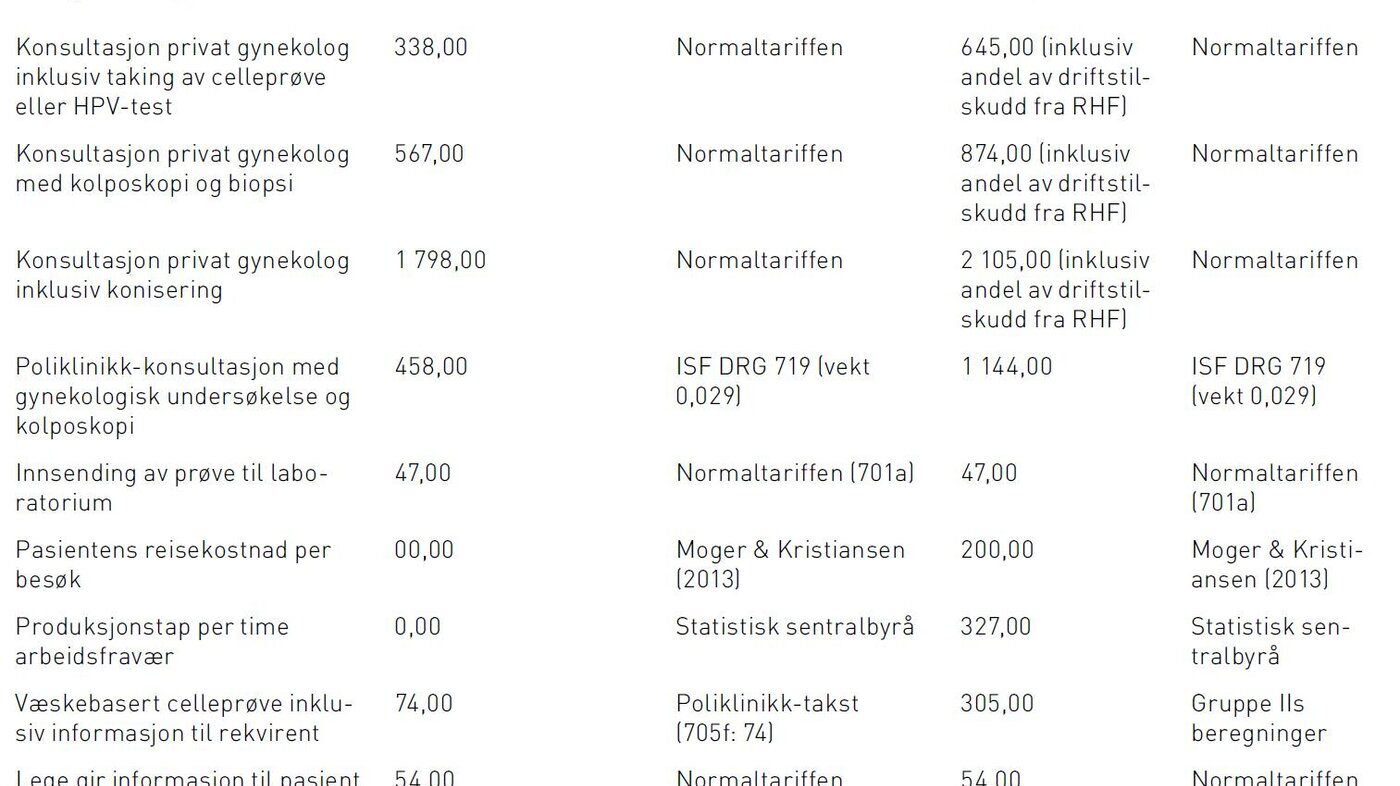
Kostnader ved laboratorienes analyse av cytologiske prøver, biopsier, konisater og HPV-tester ble basert på data om de aktuelle kostnadskomponenter i tre sykehus. Ytterligere opplysninger om disse kan fås ved henvendelse til forfatterne. Vi har også inkludert kostnadene for seksjonen for livmorhalsscreening ved Kreftregisteret, herunder administrasjon, koordinering, drift, kvalitetssikring og utvikling av Masseundersøkelsen mot livmorhalskreft. Alle kostnader er oppgitt i 2013 norske kroner.
Produktivitetstap ved screening framkommer fordi kvinner er fraværende fra arbeid når de møter til screening. Vi antok at hver screeningundersøkelse medfører to timers arbeidsfravær, mens triage med kolposkopi medfører fire timers fravær. I beregning av produktivitetstap har vi lagt til grunn gjennomsnittlig lønnsinntekt i 2012 (437.400), tillagt 40 prosent for å fange opp arbeidsgiveravgift og andre utgifter som skal dekkes i arbeidsforholdet, og antatt 1870 arbeidstimer per år. Dette resulterer i et produktivitetstap per time på kr 327. Reisekostnad for å delta i screening eller oppfølging av denne er basert på en undersøkelse av Moger og Kristiansens (21) som konkluderte at gjennomsnittlig reisekostnad for å delta i mammografiscreening var kr 190 i 2012. Vi har antatt kr 200 for å ta hensyn til inflasjon. Dette beløpet er et anslått gjennomsnitt for reisekostnad per konsultasjon for primærtest, etterkontroller og konisering.
Vi foretok énveis sensitivitetsanalyser på et utvalg av input variablene for å vurdere hvor mye usikkerheten i disse kan påvirke de totale kostnader ved programmet. Til sammen 19 variabler ble undersøkt med 25 prosent endring i positiv og negativ retning. Alle kostnadsberegninger ble gjort i et Excel regneark som kan fås ved henvendelse til forfatterne.
Resultater
I 2011 sendte Kreftregisteret påminnelser om livmorhalsscreening til 415 925 kvinner i målgruppen fordi de ikke hadde vært til undersøkelse de foregående tre år. Det ble i tillegg sendt 31.122 invitasjonsbrev med informasjon om programmet til 25-åringer. Det ble utført i alt 401 709 cytologiske prøver hvorav 360 704 gjaldt primærscreening. Av primærscreeningprøve ble 24 168 klassifisert som uegnet prøve, ASC-US, LSIL eller mer alvorlig, og derfor anbefalt etterundersøkelser. Dette resulterte i 17 759 nye cytologiske prøver og 13 430 HPV-tester i triage. Det ble innsendt biopsier for omtrent 9000 kvinner og 3057 kvinner fikk utført konisering (tabell 3).
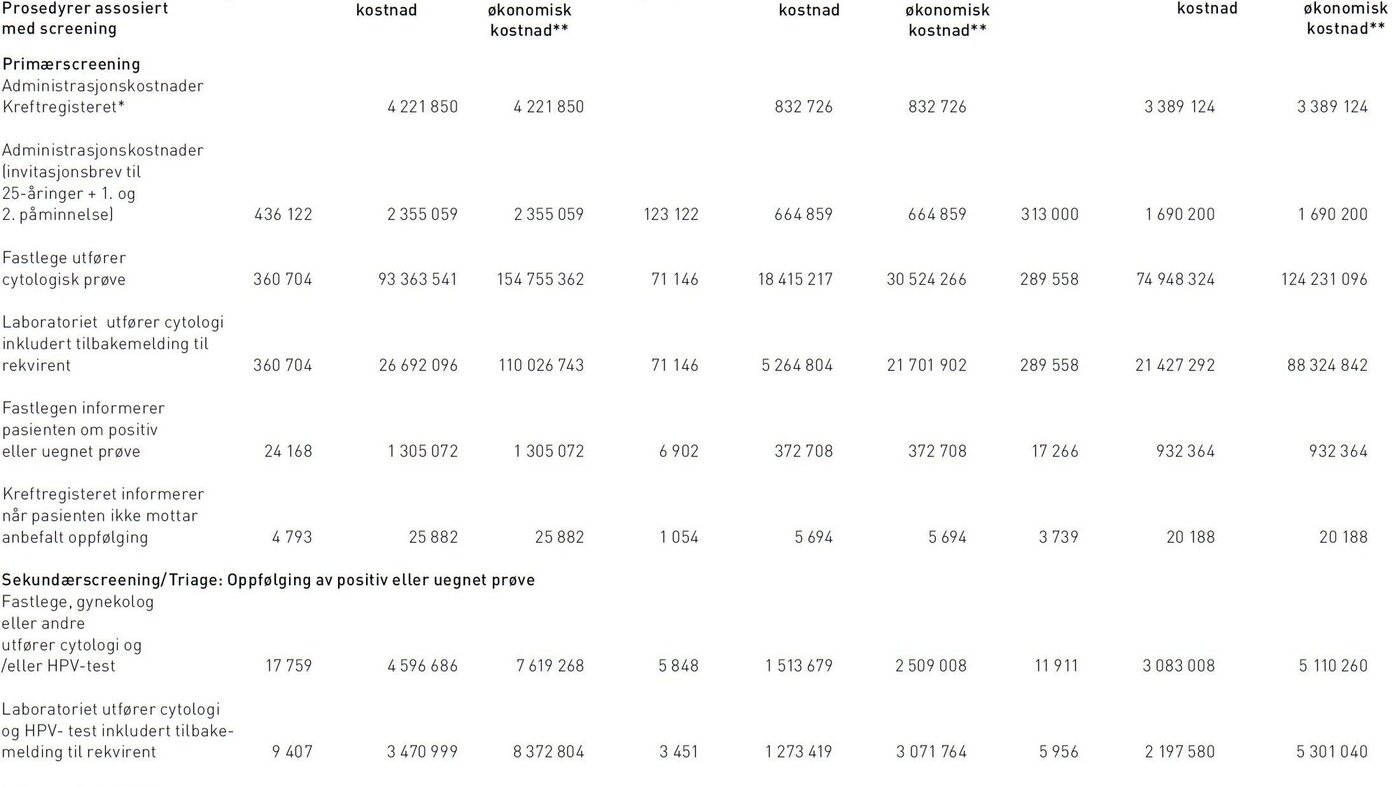
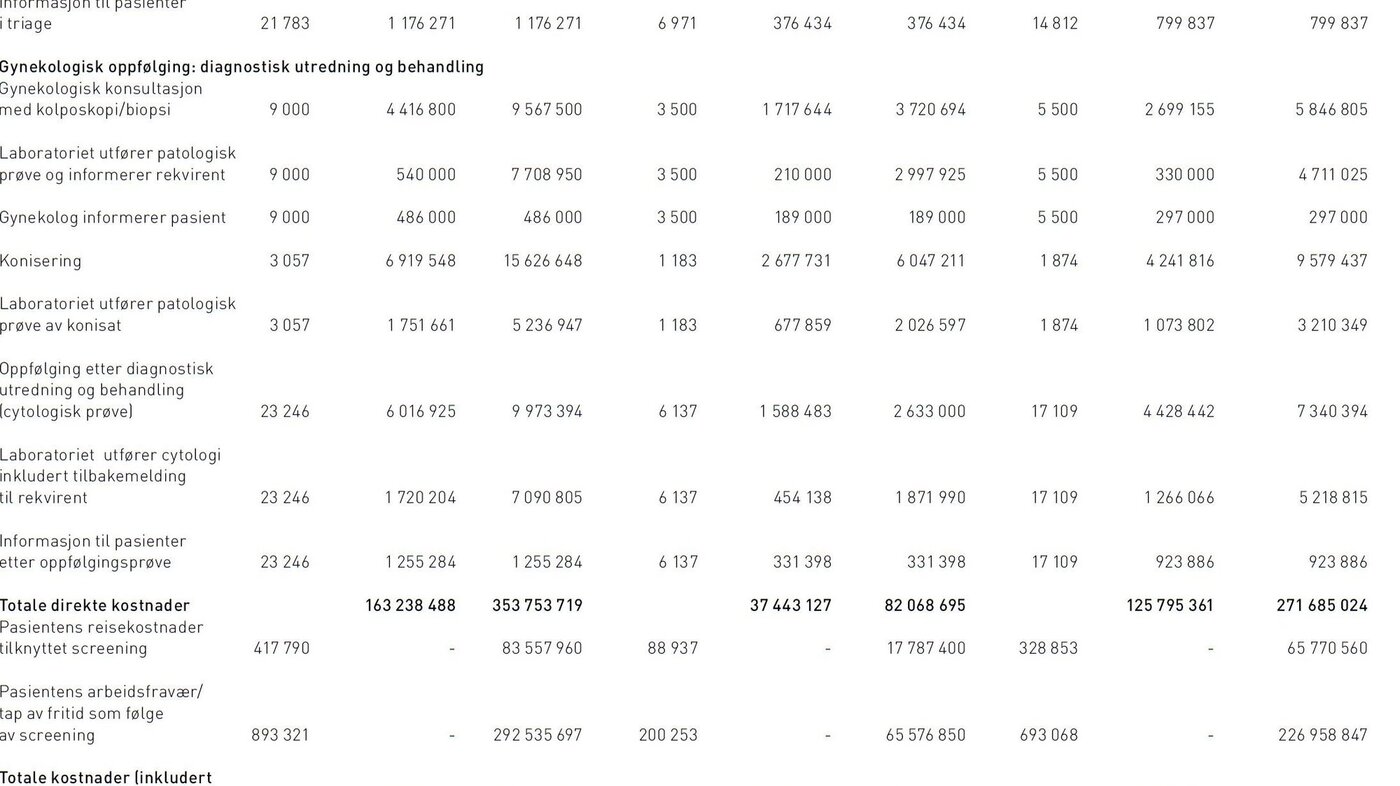
De samlete samfunnsøkonomiske kostnader ved screeningprogrammet var 730 millioner kroner, hvorav 52 prosent var indirekte kostnader i form av reisekostnader og fravær fra arbeid. Produksjonstap som følge av fravær fra arbeid i forbindelse med konsultasjoner utgjorde 78 prosent (293 millioner kroner) av de indirekte kostnadene. Direkte samfunnsøkonomiske kostnader utgjorde 354 millioner kroner, som fordelte seg på 273 millioner i primærscreening og 81 millioner i sekundærscreening (diagnostisk utredning og behandling). Kvinner i alderen 25–33 utgjorde 23 prosent av de totale samfunnsøkonomiske kostnadene. De direkte kostnadene fordelte seg på 58 prosent legekonsultasjoner (hvorav 2 prosent gjaldt informasjon om testresultat til pasienten), 41 prosent laboratoriekostnader (herav 84 prosent cytologisk prøve, 6 prosent HPV-test i kombinasjon med cytologi, 2 prosent HPV-test alene, 5 prosent biopsier, og resterende 3 prosent konisater). Administrasjonskostnader sto for mindre enn 2 prosent av de totale direkte kostnadene ved screening. Av kostnader tilknyttet legekonsultasjoner gjaldt 88 prosent (174 millioner kroner) cytologisk prøve og HPV-test, mens de resterende gjaldt kolposkopi med biopsi og konisering. Kostnader i forbindelse med kolposkopi og biopsi var 9,6 millioner kroner, mens behandling i form av konisering utgjorde 15,6 millioner kroner. Statens direkte utgifter gjennom lege-, laboratorie-, poliklinikk- og DRG-takster utgjorde 163 millioner kroner.
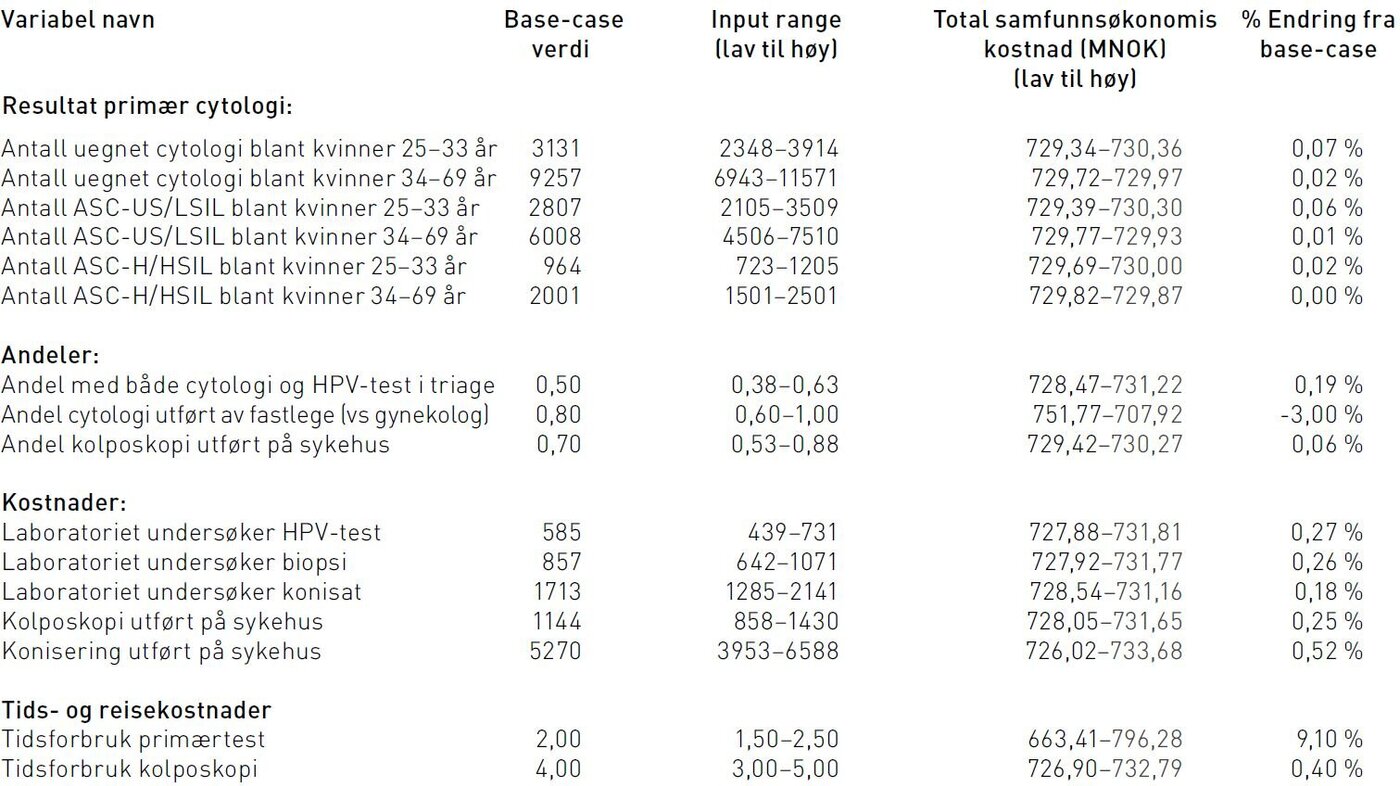
Av de 19 variablene vi gjorde sensitivitetsanalyse på, ga endringer bare i fire variabler mer enn 1 prosent endring i de totale samfunnsøkonomiske kostnadene. Endring i andel cytologi utført av fastlegen ga opptil 3 prosent endring, antall timer arbeidsfravær medført til primærprøve ga 9 prosent endring, reisekostnad ga 3 prosent endring og pasientenes tidskostnad per time ga 10 prosent endring (tabell 4).
Diskusjon
De samlete kostnadene ved forebygging av livmorhalskreft er betydelige og særlig knyttet til kvinnenes tids- og reisekostnader. Legekonsultasjoner ved primær- og sekundærtesting utgjør også en betydelig kostnad, mens laboratoriekostnadene er moderate og administrasjonskostnadene er beskjedne.
En rekke tall og forutsetninger i denne undersøkelsen er usikre. Det gjelder særlig kvinnenes tids- og reisekostnader. Når kvinner søker lege for å få tatt prøver, har vi antatt at tiden har en verdi. Dette er åpenbart tilfelle når det gjelder fravær fra lønnet arbeid, men det gjelder også tap av fritid. Når lønnsmottakere avgir fritid for å utføre overtidsarbeid, kommer verdien av fritid til syne ved at arbeidstakere får overtidsbetaling. For den minoriteten av kvinner som ikke er i lønnet arbeid, oppstår en samfunnsøkonomisk kostnad ved at de taper fritid. Denne kostnaden verdsettes vanligvis som lønnsinntekt etter skatt (22), men dette er ikke innarbeidet i analysen fordi vi ikke har sikker informasjon om hvor stor andelen av kvinnenes tidsbruk som er fritid. Vi antok at den enkelte primærscreenings- eller triage-test i gjennomsnitt betyr at kvinnen er borte to timer fra produktivt arbeid. I studien av kostnader ved mammografiscreening anslo Moger og Kristiansen (21) at totalt tidsbruk var 0,67 time per undersøkelse. Screening for livmorhalskreft er mer tidkrevende fordi det skal gjøres gynekologisk undersøkelse. På den annen side tas mange celleprøver i forbindelse med legekonsultasjon der primærhensikten ikke er screening. Tidsbruken vil ventelig være betydelig høyere ved kolposkopi eller biopsi og særlig konisering, derfor antok vi at denne prosedyren ville medføre fire timer tapt arbeid eller fritid. Enhetskostnader skal ideelt være basert på markedspriser for å reflektere de samfunnsøkonomiske kostnader. I mangel av slike har vi blant annet benyttet refusjonstakster. Disse var åpenbart for lave når det gjelder laboratoriekostnader, og det er derfor gjort beregninger basert på informasjon fra tre patologilaboratorier. Når det gjelder kostnadene av behandling av alvorlige kreftforstadier er disse marginalt underestimert, da vi ikke har tatt hensyn til at en liten andel av disse kvinnene får utført hysterektomi.
Da det tar noe tid å kvalitetssikre og publisere data fra registre, har vi brukt 2011-data om antall undersøkelser. Vi valgte likevel å bruke 2013-tall for kostnader for at kostnadstallene skal være mest mulig oppdatert. En vesentlig styrke ved undersøkelsen er at grunnlagsdataene stammer fra Kreftregisteret som formodentlig har nokså komplett oversikt over cytologi-, histologi- og HPV-tester. Da disse testene nødvendigvis krever en legekonsultasjon, er formodentlig også antall konsultasjoner nokså korrekte. Undersøkelsen er basert på tall for kvinner i screeningalder, det vil si 25–69 år, og alle undersøkelser utført for kvinner utenfor dette aldersintervallet er holdt utenfor. I praksis medfører screeningprogrammet undersøkelser også av kvinner utenfor målgruppen («vill-screening»), slik at de totale kostnadene vil være noe høyere.
De dominerende kostnader ved det norske screeningprogrammet er legekonsultasjoner og kvinnenes tids- og reisekostnader. Administrasjonskostnadene er derimot svært lave. Kostnadene kan muligens virke svært høye, men ligger på det nivå man må vente når så mange personer har legeundersøkelse og får tatt laboratorietester. Kostnadene kan muligens reduseres noe ved sentralisering av patologiske og virologiske tester, men reduksjonen vil nødvendigvis være moderat. Den dominerende del av kostnadene er knyttet til konsultasjoner hos lege og kvinnenes tidstap i forbindelse med dette. Potensialet for reduksjon av kostnadene ligger først og fremst i reduksjon av kvinnenes tidstap ved screening. Tiltak her forutsetter at vi først skaffer kunnskap om hva tidstapet er i dag, og om mulighetene for å redusere det.
Dessverre er frammøtet svakt synkende, og 24 prosent av kvinner i screeningalder har ikke tatt prøve innen fem år fra siste prøve (14). Manglende deltakelse i screening representerer riktignok en kostnadsbesparelse, men en uønsket sådan. Tvert imot er det beregnet at det kan være samfunnsøkonomisk lønnsomt å bruke ressurser på å øke frammøtet (23).
Det nåværende programmet har vært en suksess for så vidt som den treårige dekningsgraden av målgruppen har økt samtidig som antall prøver har blitt redusert og forekomsten av livmorhalskreft har falt (24). En svakhet ved screening for livmorhalskreft er at cytologiske og histologiske kreftforstadier ikke er perfekte indikasjoner på utvikling av invasiv kreft. Invasiv kreft kan forekomme på tross av normal cytologi (13), og en betydelig andel av påviste forstadier forsvinner av seg selv (25). Konisering er riktignok et lite kirurgisk inngrep, men det kan gi redusert fertilitet og sein-
abort ved senere svangerskap (26) dersom behandlingsaktiviteten ikke er adekvat kvalitetssikret (27). Det er rimelig å anta at en betydelig andel av de 3000 kvinnene som får utført konisering, aldri ville ha utviklet invasiv kreft, men vi vet ikke hvor stor andelen er eller hvem de er. Flere store, randomiserte studier har vist at man kan oppdage flere forstadier med HPV-tester enn med cytologi, men samtidig øker sannsynligheten for positive primærscreeningprøver hos kvinner der behandlingstrengende forstadier ikke foreligger (28).
Det har blitt gjort kostnad-effekt-analyser av Masseundersøkelsen mot livmorhalskreft i Norge, og disse tyder på at dagens screeningprogram (sammenliknet med ingen organisert screening) kan bli ansett som god verdi for pengene gitt felles målestokk for kostnadseffektivitet i Norge (29). Endringer i dagens screeningprogram kan imidlertid føre til mer effektiv ressursbruk, som er vist i den samme analysen og av andre (30). Screening medfører imidlertid både fordeler og ulemper; mens screening er en fordel for dem som får fjernet forstadier som ellers ville ha utviklet seg til invasiv kreft, kan den være en ulempe for kvinner som er falskt positive og blir unødvendig bekymret, samt kvinner som screener falskt negativt. Fordelene av screening bør derfor veies opp mot de kostnader og ulemper ordningen medfører, og det er opp til hver enkelt kvinne å vurdere disse avveiningene i lys av egne preferanser.
Konklusjon
Det norske screeningprogrammet for livmorhalskreft har høye kostnader, men gir likevel verdi for pengene. En betydelig andel av disse kostnadene er drevet av pasients tid og reisekostnader, som er tilknyttet stor usikkerhet. Det er likevel nødvendig å inkludere disse ved evaluering av de totale kostnadene av screening.
Interessekonflikter: SL, SWS og ISK har vært medlem av en arbeidsgruppe som utredet bruk av HPV-test i screening for livmorhalskreft.
Referanser
1. GLOBOCAN. GLOBOCAN 2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012. 2012 09.04.2014); Available from: http://globocan.iarc.fr/Pages/fact_sheets_cancer.aspx.
2. Larønningen S et al. NORDCAN – Cancer data from the Nordic countries. 2013, Cancer Registry of Norway: Oslo.
3. Syrjanen K et al. Prevalence, incidence, and estimated life-time risk of cervical human papillomavirus infections in a nonselected Finnish female population. Sex Transm Dis,1990; 1:15–9.
4. Tjalma WA et al. Differences in human papillomavirus type distribution in high-grade cervical intraepithelial neoplasia and invasive cervical cancer in Europe. Int J Cancer, 2013,132;4:854–67.
5. zur Hausen H. Papillomaviruses in the causation of human cancers – a brief historical account. Virology, 2009; 384;2:260–5.
6.Tota, JE et al. Epidemiology and burden of HPV infection and related diseases: implications for prevention strategies. Prev Med, 2011,53;1:12–21.
7. Preisler S et al. Prevalence of human papillomavirus in 5,072 consecutive cervical SurePath samples evaluated with the Roche cobas HPV real-time PCR assay. PLoS One, 2013,8;3:59765.
8. Peirson L et al. Screening for cervical cancer: a systematic review and meta-analysis. Syst Rev, 2013,2:35.
9. Vaccarella S et al. 50 years of screening in the Nordic countries: quantifying the effects on cervical cancer incidence. Br J Cancer, 2014;111:965–9.
10. Kristiansen IS. Hva er evidensbasert medisin? Tidsskr Nor Laegeforen, 2012;132:638–9.
11. Engholm G et al. NORDCAN: Cancer Incidence, Mortality, Prevalence and Survival in the Nordic Countries. 2013, Association of the Nordic Cancer Registries. Danish Cancer Society.
12. Johansen BK et al. Masseundersøkelsen mot livmorhalskreft. Årsrapport 2008. 2009: Oslo, Kreftregisteret.
13. Skare GB and Lönnberg S. Masseundersøkelsen mot livmorhalskreft. Årsrapport 2012. 2014, Kreftregisteret. Institutt for populasjonsbasert kreftforskning: Oslo.
14. Kreftregisteret. Årsrapport 2009–2011. Masseundersøkelsen mot livmorhalskreft. 2013, Kreftregisteret. Institutt for populasjonsbasert kreftforskning. Oslo.
15. Stortingsmelding om folkehelse: God helse – felles ansvar. Pressemelding, 26.04.2013. Nr.: 13/2013. 2013, Helse- og omsorgsdepartementet.
16. Helsedirektoratet. Økonomisk evaluering av helsetiltak – en veileder. 2012.
17. Helsedirektoratet. Innsatsstyrt finansiering 2013. 2013.
18. Lovdata. Forskrift om godtgjørelse av utgifter til helsehjelp som utføres poliklinisk ved statlige helseinstitusjoner og ved helseinstitusjoner som mottar driftstilskudd fra regionale helseforetak.
19. Normaltariff for privat allmennpraksis 2012–13. Den norske legeforening.
20. Normaltariff for privat spesialistpraksis 2011–12. Den norske legeforening.
21. Moger TA and Kristiansen IS. Direct and indirect costs of the Norwegian Breast Cancer Screening Program. HERO Working Paper 2012 (2012:3).
22. NOU 2012: 16 Samfunnsøkonomiske analyser. Oslo.
23. Burger EA and Kim JJ. The value of improving failures within a cervical cancer screening program: An example from Norway. International Journal of Cancer, 2014.
24. Haldorsen T et al. Livmorhalskreft etter ti års offentlig koordinert screening. Tidsskrift for Den norske legeforening. 2008;128:682–5.
25. McCredie MR et al. Natural history of cervical neoplasia and risk of invasive cancer in women with cervical intraepithelial neoplasia 3: a retrospective cohort study. Lancet Oncol, 2008;9:425–34.
26. Albrechtsen S et al. Pregnancy outcome in women before and after cervical conisation: population based cohort study. Bmj, 2008;337:1343.
27. Castanon A et al. Risk of preterm birth after treatment for cervical intraepithelial neoplasia among women attending colposcopy in England: retrospective-prospective cohort study. Bmj, 2012;345:5174.
28. Ronco G et al. Efficacy of HPV-based screening for prevention of invasive cervical cancer: follow-up of four European randomised controlled trials. Lancet, 2014;383:524–32.
29. Burger EA et al. Cost-effectiveness of cervical cancer screening with primary human papillomavirus testing in Norway. Br J Cancer, 2012;106:1571–8.
30. Goldie SJ et al. J.D. Goldhaber-Fiebert, and G.P. Garnett, Chapter 18: Public health policy for cervical cancer prevention: the role of decision science, economic evaluation, and mathematical modeling. Vaccine, 2006. 24 Suppl 3: p. S3/155–63.









0 Kommentarer