Mild kognitiv svikt og fysisk funksjonsnivå blant hjemmeboende eldre
Sammendrag
Bakgrunn: Mild kognitiv svikt (MKS) er en tilstand med reduserte kognitive evner utover vanlig aldring, men som ikke er demens. Studier gir støtte til at MKS har sammenheng med fysisk funksjon og økt falltendens hos eldre, men de fleste studiene omhandler eldre fra kliniske populasjoner. Med tanke på risikovurdering og forebygging er det også nødvendig å ha kunnskap om fysisk funksjon og MKS hos hjemmeboende eldre i den generelle befolkningen.
Hensikt: Å beskrive forekomst av MKS og fysisk funksjon hos hjemmeboende eldre i tillegg til å sammenlikne fysisk funksjonsnivå og aktivitetsnivå hos hjemmeboende eldre med og uten MKS.
Metode: En tverrsnittsstudie med data fra 1265 hjemmeboende kvinner og menn som var ≥ 70 år ved deltakelse i befolkningsstudien HUNT4 Trondheim 70+ i 2018–2019. Vi kartla fysisk og kognitiv funksjon med validerte måleinstrumenter. Deltakerne bidro i tillegg med data om gripestyrke og fysisk aktivitet målt ved akselerometer.
Resultat: De aldersjusterte skårene viste at 17,8 prosent av kvinnene og 21,3 prosent av mennene hadde MKS. Majoriteten av de hjemmeboende eldre som deltok i HUNT4 Trondheim 70+, hadde høyt funksjonsnivå. Det var likevel langt flere kvinner enn menn i alle alderskategorier som hadde skårer som indikerte økt risiko for funksjonssvikt. Både kvinner og menn med MKS hadde lavere fysisk funksjonsnivå, lavere gripestyrke og lavere ganghastighet, og de gikk færre skritt på den mest aktive dagen sammenliknet med de uten MKS.
Konklusjon: Forekomsten av MKS i utvalget vårt var lavere enn i HUNT4 70+, men på linje med funn fra flere internasjonale studier. Det var ingen forskjell i selvrapportert nedsatt funksjonsnivå mellom deltakere med og uten MKS, men både kvinner og menn med MKS hadde statistisk signifikant lavere skår på samtlige funksjonsmål.
Referer til artikkelen
Antonsen E, Skjerve K, Grønvik K, Brattgjerd T, Gjøra L, Thingstad P, Ernstsen L. Mild kognitiv svikt og fysisk funksjonsnivå blant hjemmeboende eldre. Sykepleien Forskning. 2021;16(86437):e-86437. DOI: 10.4220/Sykepleienf.2021.86437
Mellom normal aldring og patologi finner man tilstanden mild kognitiv svikt (MKS). MKS innebærer svikt i kognitiv funksjon, men ikke større enn at personen er selvstendig når det gjelder aktiviteter i dagliglivet (1). Det anslås at 10–20 prosent i alderen 65 år eller eldre har MKS, og de fleste bor hjemme (1).
Ifølge ferske tall fra Helseundersøkelsen i Trøndelag har 35,5 prosent av dem som er 70 år og eldre, MKS (2). Personer med MKS har økt risiko for å utvikle demens sammenliknet med kognitivt friske, og hvert år utvikler omtrent 10 prosent av personer med MKS demens (3).
Sammenhengen mellom MKS og demensutvikling er likevel uklar, og det er i dag mye forskning på dette området. Nyere kunnskapsoversikter gir samtidig støtte til at gripestyrke (4), ganghastighet (5) og fysisk aktivitet (6) er assosiert med kognitiv funksjon hos middelaldrende og eldre.
Fysisk aktivitetsnivå er også foreslått som en av de viktigste modifiserbare risikofaktorene for funksjonssvikt og demens (7). En studie som undersøkte endring i kognitiv funksjon over en tidsperiode på 14 år blant personer som var 65 år eller eldre ved studiestart, fant en tydelig sammenheng mellom samtidig nedgang i kognitiv og fysisk funksjon (8).
Kognitiv funksjon er avgjørende for å gjennomføre aktiviteter i dagliglivet, og man antar at ved å gjennomføre ulike aktiviteter som utfordrer bevegelsesapparatet, kan man både vedlikeholde og øke det kognitive funksjonsnivået.
Vi vet samtidig lite om forekomsten av MKS og fysisk funksjonsnivå hos hjemmeboende eldre i Norge og i hvilken grad det er forskjeller i funksjonsnivået mellom de som har og de som ikke har MKS. Et viktig mål i den norske helsepolitikken er at eldre skal ha mulighet til å være mest mulig selvhjulpne, og klare seg selv i størst mulig grad (9).
Behov for kunnskap om funksjonsnivå blant eldre i den generelle befolkningen ble trukket frem i samhandlingsreformen fra 2009 (10), og allerede den gang poengterte myndighetene at «[t]jenestene preges av for liten innsats for å begrense og forebygge sykdom» (10, s. 13).
Ifølge tall fra Statistisk sentralbyrå vil andelen av befolkningen som er 80 år eller eldre, mer enn tredobles innen 2060 (til 720 000) (11), og i 2050 vil det være omtrent tre ganger så mange personer med demens som det er i dag (12).
Å ha valid og oppdatert kunnskap om helse og funksjonsnivå blant hjemmeboende eldre er avgjørende for tidlig innsats og kommunal planlegging og innovasjon i utdannings-, pleie- og omsorgssektoren (9, 10).
Hensikten med studien
Målene med denne tverrsnittsstudien er å beskrive forekomsten av MKS samt fysisk funksjonsnivå hos hjemmeboende eldre. I tillegg sammenlikner vi fysisk funksjonsnivå og fysisk aktivitetsnivå hos eldre hjemmeboende med og uten MKS.
Metode
Studiepopulasjon
I løpet av høsten 2018 og våren 2019 inviterte vi alle fastboende innbyggere i en bydel i Trondheim, totalt 5087 personer i alderen ≥ 70 år, til å delta i studien. Deltakere som av ulike årsaker ikke kunne møte på feltstasjonen, fikk tilbud om å bli oppsøkt i sin egen bolig eller i en heldøgnsinstitusjon.
Vi samlet inn data fra spørreskjemaer og ulike kliniske tester etter samme protokoll som understudien i den fjerde Helseundersøkelsen i Trøndelag (HUNT4 70+), som ble gjennomført i 2017–2019.
En del av hensikten med HUNT4 Trondheim 70+ var å kartlegge helsen hos et representativt utvalg i en norsk storby. Helsepersonell samt sykepleierstudenter på det andre studieåret ved NTNU Trondheim med sertifisert opplæring utførte datainnsamlingen. Av de 5087 inviterte valgte 1749 å delta (34 prosent av de inviterte).
Utvalget for denne studien
Av de 1749 som deltok i HUNT4 Trondheim 70+, svarte 1333 at de bodde i sin egen leilighet eller bolig, og vi ekskluderte 279 som ikke hadde svart på dette spørsmålet. Deretter ekskluderte vi deltakere som manglet komplette svar på instrumentene som ble benyttet til kartleggingen av kognitiv funksjon og fysisk form (n = 68).
Det endelige utvalget for studien besto dermed av 1265 deltakere. For noen av enkeltvariablene var det noen som manglet svar. Antallet responser på hvert av spørsmålene vi benyttet, går frem av tabellene.
Demografiske variabler
Alder er beskrevet som antallet år. Vi omgjorde utdanning til en dikotom variabel med enten høy eller lav utdanning. Deltakerne i kategorien lav utdanning hadde fullført grunnskole, ett–to år på videregående skole, tre år på videregående skole eller tatt fagbrev eller svennebrev.
Deltakerne i kategorien høy utdanning svarte at de hadde gjennomført mindre eller mer enn fire år med høyskole eller universitet. Vi omgjorde bostatus til en dikotom variabel: «å bo alene eller å bo sammen med noen».
I tillegg målte vi langvarig sykdom med følgende spørsmål fra spørreskjemaet: «Har du noen langvarig sykdom (minst 1 år), skade eller lidelse av fysisk eller psykisk art som nedsetter dine funksjoner i ditt daglige liv?». Vi benyttet det som en dikotom variabel med svaralternativene «ja» og «nei».
Vi kartla hvorvidt deltakeren hadde mottatt hjemmesykepleie eller vært innlagt på sykehjem det siste året, med følgende spørsmål: 1: «Har du hatt hjemmesykepleie i de siste 12 måneder?» og 2: «Har du vært innlagt på sykeheim de siste 12 måneder?». Begge spørsmål var dikotome med svarkategoriene «ja» eller «nei».
Kartlegging av fysisk funksjon
For å måle fysisk funksjon benyttet vi instrumentet Short Physical Performance Battery (SPPB) (13). SPPB er en validert test for screening av fysisk funksjon hos eldre. Den er oversatt til norsk og består av en balansetest, en reise-og-sette-seg-test og en fire meters gangtest.
Hver av deltestene gjennomføres på tid, som videre omgjøres til poeng (0–4), og som til sammen gir en totalskår på mellom 0 og 12 poeng. Skår på 9 eller lavere er assosiert med funksjonssvikt, sårbarhet, behov for sykehjemsplass og dødelighet (13).
Balansetesten er hierarkisk og deles opp i tre deler: samlede bein, semitandem- og tandemposisjon. Ganghastighet vurderes med en fire meters gangtest i normalt tempo, hvor den beste av to målinger er gjeldende. Beinstyrke vurderes til sist av en stoltest, hvor testpersonen blir bedt om å reise og sette seg fem ganger uten armbruk. Testen er enkel, krever lite utstyr og tar fem–sju minutter å gjennomføre (14).
SPPB total er fremstilt både som en kontinuerlig variabel og som fire SPPB-kategorier i tråd med Guralnik og medarbeideres (13) inndeling i originalartikkelen (0–3, 4–6, 7–9 og 10–12).
For å kunne sammenligne resultatene våre med funn fra Tromsø-studien (14) delte vi utvalget inn i aldersgrupper (70–74 år, 75–79 år, 80 år og eldre). Vi målte gripestyrke i kilo med Jamar dynamometer med tre forsøk på hver hånd. Den beste målingen benyttet vi i analysene.
Objektivt målt fysisk aktivitet
For å måle fysisk aktivitet utstyrte vi deltakerne med to akselerometre, et på korsryggen og et på låret, som de skulle ha på seg kontinuerlig i sju døgn. Analysemetoden for denne studien bygger på data fra ryggsensorene. Dag er definert fra klokken seks om morgenen og frem til midnatt. Skritt registreres kun hvis det tas minimum fire skritt sammenhengende.
Akselerometeret vi brukte, heter Axivity AX3 og har vist seg å måle aktivitet med høy sensitivitet, spesifisitet og nøyaktighet (15). I resultatdelen presenterer vi antallet skritt basert på den dagen det er registrert flest skritt.
Kartlegging av kognitiv funksjon og MKS
Vi målte kognitiv funksjon med The Montreal Cognitive Assessment Scale (MoCA) (16). Testen, som er oversatt til norsk (17), er laget for å måle milde former av MKS. Den måler kognitiv kapasitet på en rekke områder: hukommelse, orienteringsevne, språk, forståelse og visuokonstruksjon. Man kan oppnå en totalskår på inntil 30 poeng, der høyere skår indikerer bedre kognitiv funksjon. Testen tar omtrent 10–15 minutter å gjennomføre.
Det er ingen konsensus i litteraturen når det gjelder hvilken skår man skal sette som grense for MKS. I denne studien valgte vi å benytte samme aldersspesifikke grenseverdier som er brukt i veilederen til HUNT4 Trondheim 70+.
For deltakere i aldersgruppen 70–79 år er grenseverdien < 22 poeng, i gruppen 80–89 år er grenseverdien < 21 og blant dem ≥ 90 år er grenseverdien < 20. Disse aldersspesifikke grensene inngår i den dikotome variabelen MKS («ja» eller «nei»).
Statistiske analyser
Utvalget er presentert etter kjønn i tabell 1 og med univariate analyser i tabell 2, der vi har sammenliknet hjemmeboende deltakere med og uten MKS (presentert etter kjønn). Vi presenterer kategoriske variabler i antall og prosent, og kontinuerlige variabler presenterer vi med gjennomsnitt og standardavvik.
Forskjeller mellom kategoriske variabler testet vi med en kjikvadrattest, mens vi testet forskjeller mellom kontinuerlige variabler med t-test for uavhengige utvalg. Ved forventet verdi på 5 eller mindre i en av rutene i krysstabellen benyttet vi Fishers eksakte test.
I tilfeller der spredningen var for ulik mellom gruppene, benyttet vi Welch-test istedenfor t-test (18). Vi valgte et signifikansnivå på 0,05 for de statistiske testene av forskjeller (tabell 2). Analysene utførte vi i statistikkprogrammet IBM SPSS 26.0.
Etiske overveielser
Alle deltakere har gitt informert samtykke til at data fra forskningsprosjektet HUNT4 Trondheim 70+ blir brukt i forskning. Denne studien er godkjent av Regionale komiteer for medisinsk og helsefaglig forskning (85430/REK-Midt). Håndtering og lagring av data er i tråd med personvernforordningen (GDPR) og NTNUs gjeldende regelverk for å lagre og bruke helsedata.
Resultater
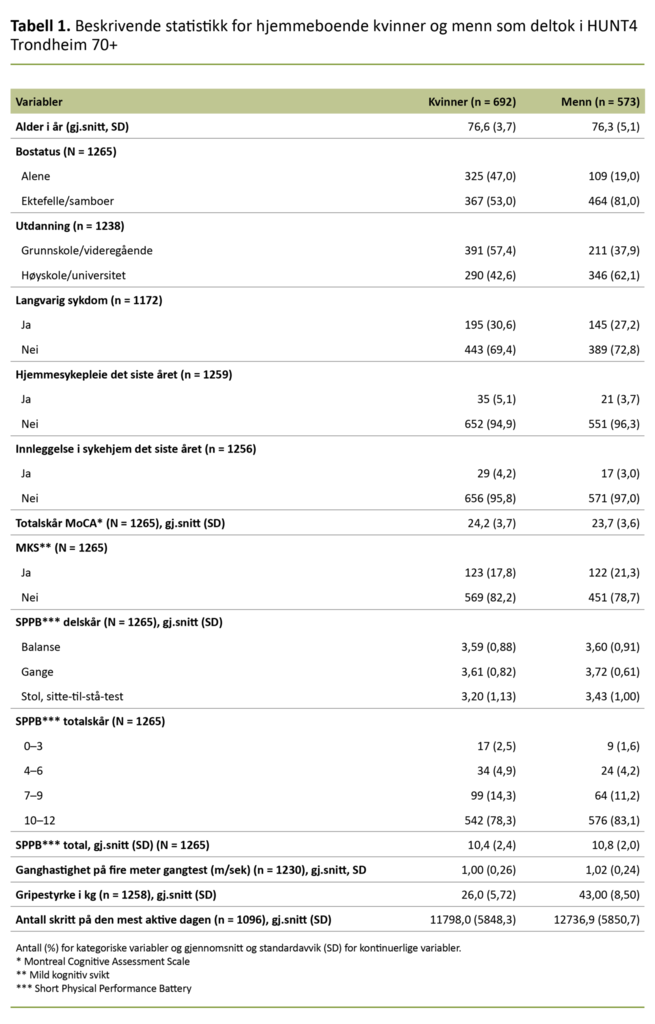
Av de 1265 deltakerne med fullstendige data fra både MoCA-test og SPPB var 692 kvinner (54,7 prosent) og 573 menn (45,3 prosent). Demografiske variabler for utvalget er presentert i tabell 1.
Mens 47 prosent av kvinnene oppga at de bodde alene, oppga kun 19 prosent av mennene det samme. Det var også flere kvinner med kun grunnskole eller videregående skole (57,4 prosent) sammenliknet med menn (37,9 prosent).
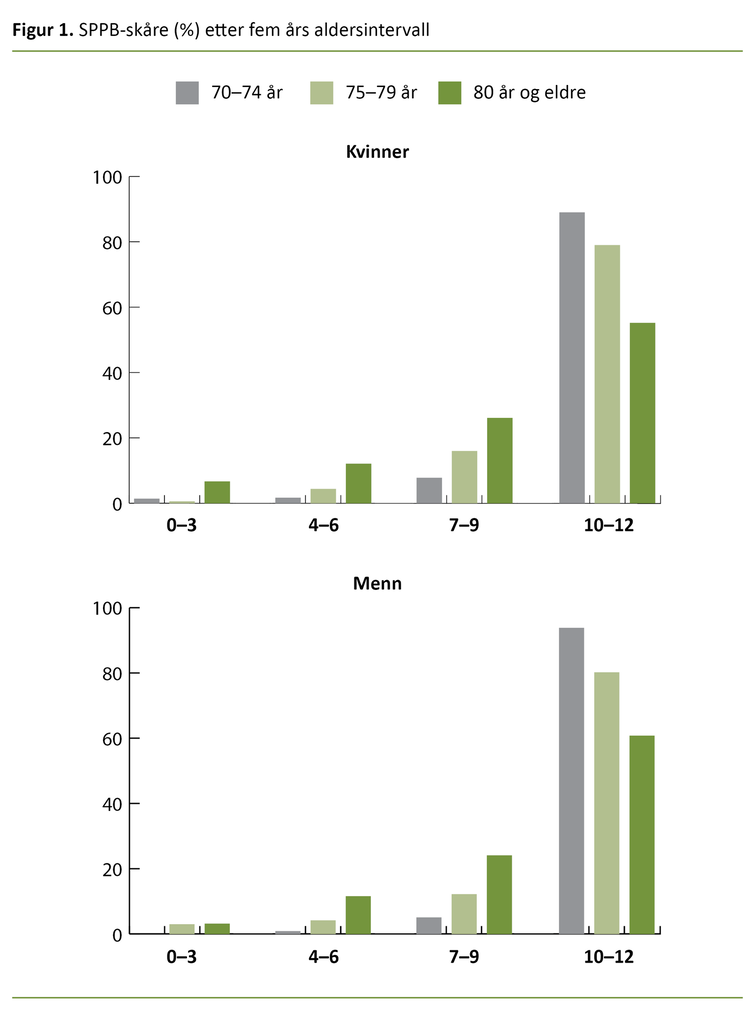
Omtrent en tredjedel av både kvinner og menn oppga at de hadde hatt langvarig fysisk eller psykisk sykdom det siste året som hadde bidratt til nedsatt funksjonsnivå. Gjennomsnitt i totalskår på SPPB var høyere for menn enn kvinner (p = 0,005) (tabell 1) med størst spredning blant kvinnene. Dette fremgår i figur 1, der vi ser at det er flere kvinner enn menn som har SPPB-skår som er lavere enn 10.
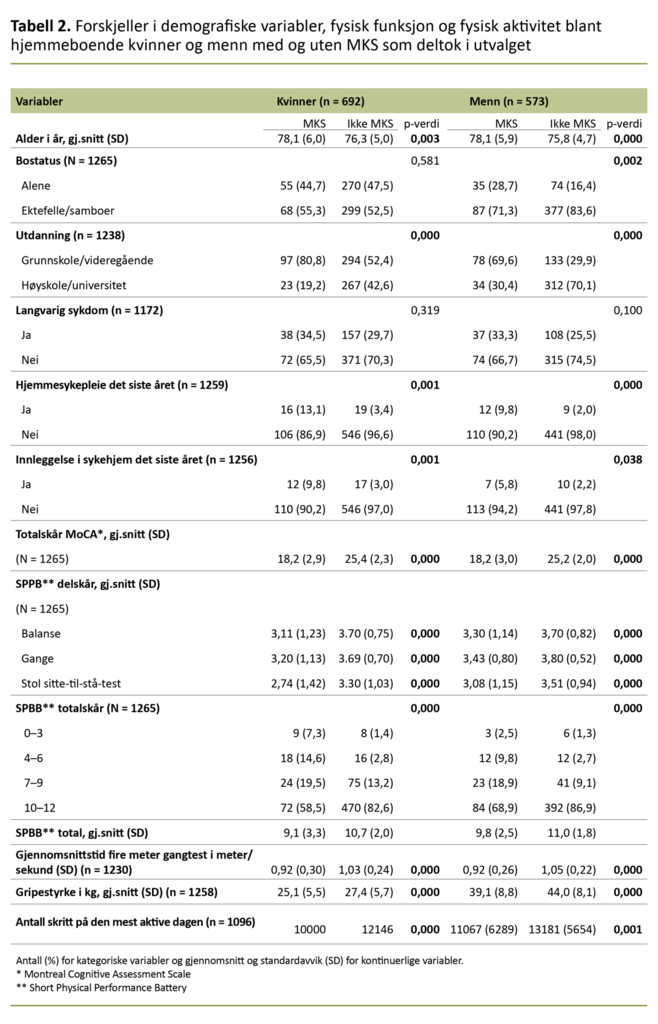
Blant dem som var 80 år eller eldre, hadde 60,8 prosent av mennene og 55,2 prosent av kvinnene høyt funksjonsnivå. Det var ingen forskjell i ganghastighet mellom kvinner og menn (p = 0,375), men menn hadde flere skritt på den mest aktive dagen i måleperioden (p = 0,008) og bedre gripestyrke enn kvinnene (p = 0,000). Sammenlikning mellom gruppene med og uten MKS er presentert separat for kvinner og menn i tabell 2.
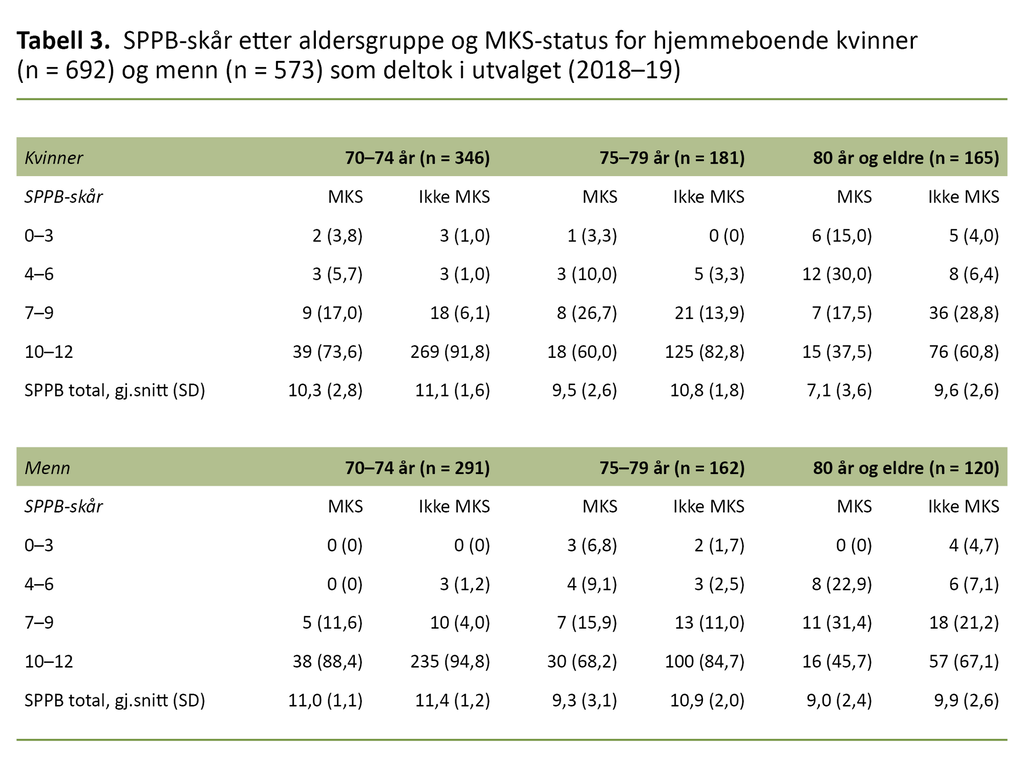
Det var en statistisk signifikant forskjell for de aller fleste variablene i sammenlikningen mellom de med og uten MKS, både for kvinner og menn. For variabelen langvarig sykdom var det ingen forskjell mellom gruppene verken blant kvinner eller menn. SPPB-skår etter aldersgrupper og MKS-status er vist for kvinner i tabell 3.
Det var langt færre med MKS som hadde høy SPPB-skår (10–12) sammenliknet med de uten MKS – både blant kvinner og menn.
Diskusjon
Målet med denne studien var å 1) beskrive forekomst av MKS og fysisk funksjon hos hjemmeboende eldre og 2) sammenlikne fysisk funksjonsnivå og fysisk aktivitetsnivå hos hjemmeboende eldre med og uten MKS.
Forekomst av MKS og fysisk funksjonsnivå
Forekomsten av MKS var størst blant menn
Forekomsten av MKS basert på aldersjustert MoCA-skår var 17,8 prosent blant kvinnene og 21,3 prosent blant mennene, totalt 19,4 prosent. Disse funnene sammenfaller med konklusjonen i en oversiktsartikkel fra 2014, der 10–20 prosent av dem som var 65 år eller eldre, oppfylte kriteriene for MKS (1).
Andelen med MKS i vårt utvalg var likevel langt lavere sammenliknet med funn fra HUNT4 70+, der forekomsten av MKS var 33,0 prosent blant kvinner og 38,1 prosent blant menn (2). Plausible forklaringer på dette er at gjennomsnittsalderen for deltakerne i utvalget vårt var lavere, og at utdanningsnivået var høyere.
At forekomsten av MKS var størst blant menn, sammenfaller med funn fra flere andre studier.
At forekomsten av MKS var størst blant menn, sammenfaller med funn fra flere andre studier (2, 19, 20). I en svensk studie av 748 eldre fra den generelle befolkningen fant Borland og medarbeidere (20) at høy alder, kjønn (menn) og lavt utdanningsnivå predikerte MKS målt ved MoCA.
En forholdsvis ny metaanalyse som inkluderte 56 studier, konkluderte derimot med at det ikke var kjønnsforskjeller i prevalens eller insidens av amnestisk MKS, men at prevalensen av ikke-amnestisk MKS var høyere blant kvinner enn menn (21).
Da vi målte global MKS i studien vår og ikke skilte på om deltakerne hadde svikt i hukommelsen (amnestisk type) eller kun svikt på andre områder for kognisjon (ikke-amnestisk), er det ikke mulig å fastslå kjønnsforskjeller i MKS etter type kognitiv utfordring.
Det var ingen kjønnsforskjell i ganghastighet
Våre funn med lavere funksjonsnivå blant kvinner enn menn samsvarer med funn fra Tromsøstudien (14). Den aldersrelaterte nedgangen i fysisk funksjon startet også tidligere hos kvinner enn hos menn.
Bergland og Strand konkluderer med at SPPB gir betydelige gulv- og takeffekter. Det vil si at mer enn 20 prosent av utvalget ligger i dårligste eller beste kategori (22), og at SPPB-totalskår, tid brukt på stoltesten eller ganghastigheten gir et bedre bilde av fysisk funksjon hos hjemmeboende eldre.
Til tross for at nærmere 76 prosent av utvalget vårt lå i beste SPPB-kategori (10–12), fant vi ingen kjønnsforskjell i ganghastighet i hele utvalget eller innenfor de ulike aldersgruppene. Dette samsvarer med funnene for deltakere på 80 år og eldre i Tromsøstudien, mens menn i aldersgruppen 70–79 år gikk signifikant raskere enn kvinnene på samme alder (14).
Mennene hadde likevel flere skritt enn kvinnene på den mest aktive dagen i måleperioden.
At det ikke forelå kjønnsforskjeller i selvrapportert langvarig kronisk sykdom i utvalget vårt, kan ha bidratt til at vi ikke fant kjønnsforskjeller i ganghastighet for dem som var yngre enn 80 år. Mennene hadde likevel flere skritt enn kvinnene på den mest aktive dagen i måleperioden.
En oversiktsartikkel anslår at friske eldre som følger anbefalingene om en halvtime fysisk aktivitet per dag, i gjennomsnitt vil avlegge 8000–10 000 skritt daglig (23). I hele utvalget var antallet skritt på den mest aktive dagen nærmere 12 000 blant kvinnene mot nærmere 13 000 blant menn.
Ettersom antallet skritt på den mest aktive dagen ikke kan sammenliknes med studier som oppgir gjennomsnittsverdier for skritt i løpet av hele måleperioden, kan vi ikke si noe om hvorvidt deltakerne i vår studie møtte anbefalingene for ukentlig fysisk aktivitet.
Antall skritt er assosiert med kognitiv funksjon
Både kvinner og menn med MKS hadde statistisk signifikant lavere SPPB-skårer enn de uten MKS. Blant kvinner med MKS var det i tillegg langt flere med lavere SPPB-skår (0–6) enn for menn med MKS. Dette mønsteret holdt seg i stratifiserte analyser etter aldersgruppe og MKS-status.
Ganghastighet, gripestyrke og antallet skritt var også betydelig lavere hos dem som hadde MKS, sammenliknet med dem uten.
Ganghastighet, gripestyrke og antallet skritt var også betydelig lavere hos dem som hadde MKS, sammenliknet med dem uten. Disse funnene samsvarer med en metaanalyse av 26 tverrsnittsstudier som fant støtte for at det var en negativ sammenheng mellom ulike mobilitetsmål og kognitiv funksjon (24).
Nyere forskning gir i tillegg støtte til at antallet skritt per dag er assosiert med kognitiv funksjon, der personer i en tidlig fase med MKS går langt flere skritt per dag sammenliknet med personer med uttalt MKS (25).
Også studier som har fulgt deltakere over tid, finner sammenheng mellom SPPB og reduksjon i aktiviteter i dagliglivet (ADL) i tillegg til økt behov for sykehjemsplass og tidlig død (13).
Svak gripestyrke er en markør for kognitiv status
I en oversiktsartikkel fra 2017 konkluderte forfatterne med at gripestyrke kan brukes til å observere endringer i kognitiv funksjon, og at redusert gripestyrke over tid kan predikere kognitiv svikt hos eldre (26). Det kan skyldes at gripestyrke er korrelert med muskelstyrke (27). Redusert fysisk funksjon og muskelstyrke viser i tillegg sammenheng med antallet liggedøgn i sykehus og sykehusrelatert død (28).
Det er likevel interessant at vi ikke fant forskjell mellom de som hadde MKS, og de som ikke hadde MKS, i andelen som oppgav at de hadde langvarig fysisk eller psykisk sykdom som nedsatte funksjoner i det daglige livet.
Det er sammenheng mellom fysisk og kognitiv funksjon uavhengig av sykdomsstatus.
Dette gjaldt både kvinner eller menn. I en norsk tverrsnittsstudie der 98 eldre pasienter med nylig diagnostisert MKS ble sammenliknet med 115 eldre pasienter uten kognitiv svikt, fant forskerne at pasientene med MKS kom statistisk signifikant dårligere ut på tre av seks fysiske tester – fysisk form, sitte-til-stå-test og seksmeters gangtest – til tross for justering for demografiske faktorer som alder, utdanningsnivå og sykdomsforekomst (29).
Det føyer seg til funn fra den internasjonale forskningen som gir støtte til at det er sammenheng mellom fysisk og kognitiv funksjon uavhengig av sykdomsstatus. Det er likevel viktig å være klar over at kognisjon og fysisk funksjonsnivå ikke bare påvirkes av normale aldringsprosesser.
Mange ulike faktorer kan påvirke testresultatene: ernæringsstatus, interaksjoner eller bivirkninger av legemidler, infeksjoner, stoffskifteforstyrrelser, anemi, mental helse og søvnproblemer. Disse faktorene må vurderes hos den enkelte.
Styrker og svakheter ved studien
Styrkene ved denne studien er at vi har brukt validerte instrumenter og objektive mål på fysisk og kognitiv funksjon i en relativt stor gruppe hjemmeboende mennesker med alder ≥ 70 år.
Svakheter ved studien er den forholdsvis lave deltakelsesprosenten og at vi på nåværende tidspunkt kun har robuste maksimalverdier for antallet skritt. Det er ikke egnet til å sammenlikne med den internasjonale litteraturen, der antallet skritt i måleperioden som oftest oppgis med gjennomsnitt og spredning for hele måleperioden.
En annen generell svakhet er at det ikke foreligger konsensus i litteraturen om hvilken grense på MoCA som skal brukes for å definere MKS. Vi hadde ikke tilgang til opplysninger om hvem som ble invitert og ikke deltok i HUNT4 Trondheim 70+, men ettersom deltakelsesprosenten var forholdsvis lav, antar vi at det er de yngste, de friskeste og de med høyest utdanningsnivå som deltok (30).
Andelen som oppga å ha utdanning på høyskole- eller universitetsnivå, var også høyere i vårt utvalg (50,3 prosent) sammenliknet med deltakerne i HUNT4 70+ (32,3 prosent). Funnene fra denne studien lar seg dermed ikke generalisere til alle norske hjemmeboende personer som er 70 år eller eldre.
Konklusjon
Kartleggingen vår viste at forekomsten av MKS i dette utvalget var lavere enn i HUNT4 70+, men på linje med tall fra flere internasjonale studier.
Majoriteten av hjemmeboende eldre som deltok i HUNT4 Trondheim 70+, hadde høyt funksjonsnivå, men fysisk funksjon, gripestyrke, gangtest og antallet skritt på den mest aktive dagen var betraktelig lavere hos de med MKS, både blant kvinner og menn. Det var også langt flere kvinner enn menn i alle alderskategorier med skårer som indikerte økt risiko for funksjonssvikt.
Bruk av validerte instrumenter i klinisk sykepleiepraksis som ikke er for omfattende og tidkrevende, kan være nyttig for å iverksette og evaluere forebyggende så vel som behandlende tiltak hos hjemmeboende eldre.
Vi vil takke Nasjonal kompetansetjeneste for aldring og helse, Trondheim kommune og Helseundersøkelsen i Trøndelag (HUNT) for tilgang på data til denne studien. HUNTer et samarbeidsprosjekt mellom HUNT forskningssenter (Fakultet for medisin og helsevitenskap, Norges teknisk-naturvitenskapelige universitet – NTNU), Trøndelag fylkeskommune, Helse Midt-Norge og Folkehelseinstituttet. Vi vil også takke alle som deltok i HUNT4 Trondheim 70+, samt ansatte og studenter som bidro i datasamlingen.
Referanser
1. Langa KM, Levine DA. The diagnosis and management of mild cognitive impairment: a clinical review. JAMA. 2014;312(23):2551–61. DOI: 10.1001/jama.2014.13806
2. Gjøra L, Strand BH, Bergh S, Borza T, Brækhus A, Engedal K, et al. Current and future prevalence estimates of mild cognitive impairment, dementia, and its subtypes in a population-based sample of people 70 years and older in Norway: the HUNT Study. J Alzheimers Dis. 2021;79(3):1213–26. DOI: 10.3233/jad-201275
3. Roberts RO, Knopman DS, Mielke MM, Cha RH, Pankratz VS, Christianson TJH, et al. Higher risk of progression to dementia in mild cognitive impairment cases who revert to normal. Neurology. 2014;82(4):317–25. DOI: 10.1212/wnl.0000000000000055
4. Carson RG. Get a grip: individual variations in grip strength are a marker of brain health. Neurobiol Aging. 2018;71:189–222. DOI: 10.1016/j.neurobiolaging.2018.07.023
5. Grande G, Triolo F, Nuara A, Welmer A-K, Fratiglioni L, Vetrano DL. Measuring gait speed to better identify prodromal dementia. Exp Gerontol. 2019;124:110625. DOI: 10.1016/j.exger.2019.05.014
6. Turner DT, Hu MX, Generaal E, Bos D, Ikram MK, Heshmatollah A, et al. Physical exercise interventions targeting cognitive functioning and the cognitive domains in nondementia samples: a systematic review of meta-analyses. J Geriatr Psychiatry Neurol. 2020;34(2):91–101. DOI: 10.1177/0891988720915523
7. Orgeta V, Mukadam N, Sommerlad A, Livingston G. The Lancet commission on dementia prevention, intervention, and care: a call for action. Ir J Psychol Med. 2019;36(2):85–8. DOI: 10.1017/ipm.2018.4
8. Chen T-Y, Chang H-Y. Developmental patterns of cognitive function and associated factors among the elderly in Taiwan. Sci Rep. 2016 sep;6(1):33486. DOI: 10.1038/srep33486
9. Meld. St. 15 (2017–2018). Leve hele livet. En kvalitetsreform for eldre. Oslo: Helse- og omsorgsdepartementet; 2017. Tilgjengelig fra: https://www.regjeringen.no/contentassets/196f99e63aa14f849c4e4b9b9906a3f8/no/pdfs/stm201720180015000dddpdfs.pdf (nedlastet 05.12.2020).
10. St.meld. nr. 47 (2017–2018). Samhandlingsreformen. Rett behandling – på rett sted – til rett tid. Oslo: Helse- og omsorgsdepartementet; 2017. Tilgjengelig fra: https://www.regjeringen.no/contentassets/d4f0e16ad32e4bbd8d8ab5c21445a5dc/no/pdfs/stm200820090047000dddpdfs.pdf (nedlastet 05.12.2020).
11. Gleditsch RF, Thomas MJ, Syse A. Nasjonale befolkningsframskrivinger 2020. Statistisk sentralbyrå; 2020. Tilgjengelig fra: https://www.ssb.no/befolkning/artikler-og-publikasjoner/_attachment/422992?_ts=172798fae98 (nedlastet 10.01.2020).
12. Ricci G. Social aspects of dementia prevention from a worldwide to national perspective: a review on the international situation and the example of Italy. Behav Neurol. 2019;8720904. DOI: 10.1155/2019/8720904
13. Guralnik JM, Simonsick EM, Ferrucci L, Glynn RJ, Berkman LF, Blazer DG, et al. A short physical performance battery assessing lower extremity function: association with self-reported disability and prediction of mortality and nursing home admission. J Gerontol. 1994;49(2):M85–94. DOI: 10.1093/geronj/49.2.m85
14. Bergland A, Strand BH. Norwegian reference values for the Short Physical Performance Battery (SPPB): the Tromsø Study. BMC Geriatr. 2019;19(1):216. DOI: 10.1186/s12877-019-1234-8
15. Kongsvold AM. Validation of the AX3 accelerometer for detection of common daily activties and postures. NTNU Open; 2016. Tilgjengelig fra: https://ntnuopen.ntnu.no/ntnu-xmlui/bitstream/handle/11250/2400440/Masteroppgave_Atle%20Melleby%20Kongsvold.pdf?sequence=1&isAllowed=y (nedlastet 21.05.2020).
16. Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I, et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc. 2005 apr.;53(4):695–9. DOI: 10.1037/t27279-000
17. Ihle-Hansen H, Vigen T, Berge T, Einvik G, Aarsland D, Rønning OM, et al. Montreal Cognitive Assessment in a 63- to 65-year-old Norwegian cohort from the general population: data from the Akershus Cardiac Examination 1950 Study. Dement Geriatr Cogn Disord Extra. 2017;7(3):318–27. DOI: 10.1159/000480496
18. Skovlund E. Når bør man velge en ikke-parametrisk metode? Tidsskr Den Nor Legeforening; 2020:16. Tilgjengelig fra: https://tidsskriftet.no/2017/05/medisin-og-tall/nar-bor-man-velge-en-ikke-parametrisk-metode (nedlastet 22.09.2020).
19. Petersen RC, Roberts RO, Knopman DS, Geda YE, Cha RH, Pankratz VS, et al. Prevalence of mild cognitive impairment is higher in men. Neurology. 2010;75(10):889–97. DOI: 10.1212/wnl.0b013e3181f11d85
20. Borland E, Nägga K, Nilsson PM, Minthon L, Nilsson ED, Palmqvist S. The Montreal Cognitive Assessment: normative data from a large Swedish population-based cohort. J Alzheimers Dis. 2017;59(3):893–901. DOI: 10.3233/jad-170203
21. Au B, Dale-McGrath S, Tierney MC. Sex differences in the prevalence and incidence of mild cognitive impairment: a meta-analysis. Ageing Res Rev. 2017;35:176–99. DOI: 10.1016/j.arr.2016.09.005
22. Pripp AH. Når målingen går i taket. Tidsskr Den Nor Legeforening. 2019;4. DOI: 10.4045/tidsskr.18.0880
23. Tudor-Locke C, Craig CL, Aoyagi Y, Bell RC, Croteau KA, De Bourdeaudhuij I, et al. How many steps/day are enough? For older adults and special populations. Int J Behav Nutr Phys Act. 2011;8:80. DOI: 10.1186/1479-5868-8-80
24. Demnitz N, Esser P, Dawes H, Valkanova V, Johansen-Berg H, Ebmeier KP, et al. A systematic review and meta-analysis of cross-sectional studies examining the relationship between mobility and cognition in healthy older adults. Gait Posture. 2016;50:164–74. DOI: 10.1016/j.gaitpost.2016.08.028
25. Chang Y-T. Physical activity and cognitive function in mild cognitive impairment. ASN Neuro. 2020;12:1–9. DOI: 10.1177/1759091419901182
26. Fritz NE, McCarthy CJ, Adamo DE. Handgrip strength as a means of monitoring progression of cognitive decline – a scoping review. Ageing Res Rev. 2017;35:112–23. DOI: 10.1016/j.arr.2017.01.004
27. Rantanen T, Guralnik JM, Foley D, Masaki K, Leveille S, Curb JD, et al. Midlife hand grip strength as a predictor of old age disability. JAMA. 1999;281(6):558–60. DOI: 10.1001/jama.281.6.558
28. Cunha AIL, Veronese N, de Melo Borges S, Ricci NA. Frailty as a predictor of adverse outcomes in hospitalized older adults: a systematic review and meta-analysis. Ageing Res Rev. 2019;56:100960. DOI: 10.1016/j.arr.2019.100960
29. Hesseberg K, Bergland A, Rydwik E, Brovold T. Physical fitness in older people recently diagnosed with cognitive impairment compared to older people recently discharged from hospital. Dement Geriatr Cogn Disord Extra. 2016;6(3):396–406. DOI: 10.1159/000447534
30. Langhammer A, Krokstad S, Romundstad P, Heggland J, Holmen J. The HUNT study: participation is associated with survival and depends on socioeconomic status, diseases and symptoms. BMC Med Res Methodol. 2012 sep.;12:143. DOI: 10.1186/1471-2288-12-143



















0 Kommentarer